თარგმნა: ნანო შვანგირაძე
სუპრავენტრიკულური ტაქიკარდია (ЅVΤ) განისაზღვრება, როგორც გულის არანორმალურად სწრაფი რითმი, რომელიც წარმოიქმნება პარკუჭების ზემოთ, იგი ხშირად (მაგრამ არა ყოველთვის) წარმოდგენილია ვიწრო QRS კომპლექსით; პირობითად გამორიცხულია წინაგულების თრთოლვა და წინაგულების ფიბრილაცია [1].
გადაუდებელი მართვა
SVT მქონე პედიატრიული პაციენტის მართვა ერთგვარ გამოწვევას წარმოადგენს, რადგან ხშირ შემთხვევებში უცნობია ტაქიკარდიის ზუსტი მექანიზმი. მკურნალობის ტაქტიკა დამოკიდებულია მდგომარეობის გამოვლინებაზე და ასევე პაციენტის კლინიკურ სტატუსზე (რამდენად ჰემოდინამიკურად სტაბილური ან არასტაბილურია პაციენტის მდგომარეობა). მიდგომები გულისხმობს საწყისი თერაპიის დაწყებას და პაციენტის დინამიკაში შეფასებას (იხ. ცხრილი 1).
აქ აღწერილი დისკუსიები, ეყრდნობა 2010 წლის PALS-ის გაიდლაინებს, რომელებიც შემუშავებულია ამერიკის გულის ასოციაციის (AHA) და ILCOR-ის მიერ. (ალგორითმი 1) [2]. AHA-ს და ILCOR-ის გაიდლაინები განახლდა 2015 წელს. ხოლო ტაქიარითმიების გაიდლაინები უცვლელია. [3].
ჰემოდინამიკური შეფასება და მონიტორინგი – პედიატრიულ პაციენტს, რომელსაც აღენიშნება ტაქიარითმია, დაუყოვნებლივ უნდა ჩაუტარდეს ჰემოდინამიკური მაჩვენებლების შეფასება და ელექტროკარდიოგრაფია (ეკგ) (ცხრილი 1 და ალგორითმი 1). ზოგადად სასურველია 15-განხრიანი ეკგ-ს ჩატარება. ეს მოიცავს 12 სტანდარტულ განხრას, დამატებით V3R და V4R განხრებს (მარცხნივ V3-ისა და V4-ის ანალოგიური მარჯვენა მხარე) და V7 (მარცხენა უკანა აქსილარული ხაზი V4 -ის დონეზე).
თერაპიული მანევრების დროს ეკგ-ს უწყვეტი მონიტორინგი უზრუნველყოფს ტაქიკარდიის მიზეზის იდენტიფიცირებას და გვეხმარება ქრონიკული თერაპიის დაგეგმვაში.
ტაქიარითმიის მქონე ბავშვებში ყველაზე მნიშვნელოვანი საწყისი კლინიკური გადაწყვეტილებაა იმის განსაზღვრა თუ რამდენად სტაბილურია პაციენტის ჰემოდინამიკური მაჩვენებლები, მათ შორის მნიშვნელოვანია, სახეზეა თუ არა ჰიპოტენზია, გულის უკმარისობა, ცუდი პერფუზია, შოკის ნიშნები ან ცნობიერების დონის დაქვეითება. არასტაბილური პაციენტები საჭიროებენ სასწრაფო ჩარევას პათოლოგიური რიტმის აღმოსაფხვრელად.
SVT- ის მქონე ბავშვი შეიძლება იყოს უსიმპტომოც, თუმცა შესაძლოა გრძნობდეს პალპიტაციას ან იყოს აგზნებული, იყოს უგონო მდგომარეობაშიც და აღებიშნებოდეს გულ-სისხლძარღვთა სისტემის უკმარისობის ნიშნები. გადაუდებელი მართვა დამოკიდებულია იმაზე, თუ რამდენად ჰემოდინამიურად სტაბილურია პაციენტის მდგომარეობა (ცხრილი 1).
არასტაბილური პაციენტები – არასტაბილური პაციენტები ჰემოდინამიკური კომპრომისით (მაგ. დარღვეული ცნობიერება, ცუდი პერფუზია, ჰიპოტენზია ან შოკის სხვა ნიშნები ან გულის მძიმე უკმარისობა) საჭიროებენ ტაქიარითმიის დაუყოვნებლივ აღმოფხვრას (ცხრილი 1). კარდიოვერსია წარმოადგენს საბოლოო ჩარევას.
პაციენტის მომზადება კარდიოვერსიისათვის – კარდიოვერსიისათვის მომზადებისას აუცილებელია უზრუნველყოფილი იყოს დამატებითი ჟანგბადი და დამხმარე სუნთქვისთვის საჭირო სხვა აღჭურვილობები. ადენოზინი უნდა მიეწოდოს პაციენტს კარდიოვერსიის მომზადებისას, თუ პრეპარატი ხელმისაწვდომია და ბავშვს აქვს ინტრავენური (IV) წვდომა. ანალოგიურად, ვაგალური მანევრი შესაძლებელია განხორციელდეს მედიკამენტოზური ჩარევის მომზადებისას, მაგრამ ვაგალური მანევრის ჩატარება არ უნდა გახდეს კარდიოვერსიის განხორციელების დამაყოვნებელი ფაქტორი.
ზოგადად, ბავშვს უნდა ჩაუტარდეს ადეკვატური ანალგეზია და სედაცია კარდიოვერსიის ჩატარებამდე [4,5]. იშვიათად, თუ ბავშვის მდგომარეობა კრიტიკულად მძიმეა, შეიძლება გადადებულ იქნას სედაციის პროცედურა.
კარდიოვერსია– სუპრავენტრიკულური რითმის შესაწყვეტად კარდიოვერსია ჰემოდინამიკურად არასტაბილურ პაციენტებში საბოლოო ჩარევაა. კარდიოვერსია ხორციელდება 0.5-დან 1 ჯ/კგ-მდე ენერგეტიკული დოზის გამოყენებით, რაც მცირე დოზების არაეფექტურობის შემთხვევაში [2,6]. შესაძლოა გაიზარდოს 2 ჯოულამდე. ვიწრო კომპექსური ტაქიკარდია უნდა გარდაიქმნას სინქრონის რეჟიმში, სადაც შოკი არ მიეწოდება რეპოლარიზაციის პერიოდში. ეს ფაქტორი თავიდან აგვაცილებს პარკუჭოვანი ფიბრილაციის შესაძლო განვითარებას.
როდესაც სინქრონული კარდიოვერსია სწორად არის მიწოდებული, [7-10] ძალზე ეფექტურია ყველა ტიპის SVT-სთვის და აღადგენს სინუსურ რიტმს 95%-ზე მეტ შემთხვევაში.
სტაბილური პაციენტები- პაციენტებისათვის, რომლებიც არიან ჰემოდინამიკურად სტაბილურები, შეიძლება დამატებითი დრო გამოუყოთ რითმის შესაფასებლად და ვაგალური მანევრის შესასურლებლად თუ ვაგალური მანევრი არაეფექტურია, უნდა მოხდეს ადენოზინის შეყვანა.
დიაგნოსტიკური შეფასება – ЅVТ-ს იდენტიფიცირებაში გვეხმარება ქვემოთ ჩამოთვლილი მახასიათებლები [2]:
●ტაქიკარდიის უეცარი დაწყება
●გულისცემა >220 დარტყმა/წთ ჩვილებში და >180 დარტყმა/წთ ბავშვებში
●P ტალღები არ არის ან არანორმალურია
●გულისცემა არ იცვლება აქტივობის მიხედვით
სტრუქტურულად ნორმალური გულის მქონე ბავშვებში SVT ეპიზოდების აბსოლუტური უმრავლესობა მოიცავს კლასიკურ ატრიოვენტრიკულურ (AV) რეენტრ მექანიზმს.
პოტენციური მექანიზმები მოიცავს:
●AV reentrant ტაქიკარდია (ΑVRT) გამოვლენილი ან ფარული დამატებითი გზის გამო
●AV კვანძოვანი რეენტრ ტაქიკარდია (ΑVNRΤ)
იშვიათი პედიატრიული შემთხვევები შეიძლება მოიცავდეს სხვა მექანიზმებს, როგორიცაა წინაგულების ექტოპიური ტაქიკარდია ან წინაგულების თრთოლვა.
ვაგალური მანევრები – უსიმპტომო ან მსუბუქი სიმპტომების მქონე ბავშვებს უნდა ჩაუტარდე ვაგალური მანევრები მანამდე სანამ მოხდება სამედიცინო გუნდის მობილიზება საჭიროების შემთხვევაში სამედიცინო თერაპიის გაგრძელებისთვის. ეს მანევრები უნდა ჩატარდეს ეკგ-ს მუდმივ მონიტორინგთან ერთად. ეკგ ნიმუში, რომელიც ჩანს ტაქიკარდიის შეწყვეტის დროს, დაგეხმარებათ განსაზღვროთ მისი წარმოქმნის მექანიზმი.
ჩვილებში ყველაზე ხშირად გამოყენებული ვაგალური მანევრი არის ყინულით და ცივი წყლით სავსე ტომრის დადება სახეზე 15-30 წამის განმავლობაში. ეს იწვევს მყვინთავის რეფლექსს და ხშირად წყვეტს არითმიას [11]. კიდევ ერთი მეთოდი, რომელიც შეიძლება წარმატებული იყოს ჩვილებში, არის რექტალური სტიმულაცია თერმომეტრის გამოყენებით.
უფროს ბავშვებში ვაგალური მანევრები მოიცავს ჩაბერვას (ვალსალვას მანევრი), ერთი მხრიდან დახურულ ჭურჭელში ჩაბერვას ან თავდაყირა პოზიციის მიცემას 15-დან 20 წამამდე დროის განმავლობაში.
ბავშვებში კაროტიდების მასაჟი და ორბიტალური ზეწოლა არ უნდა ჩატარდეს.
ვაგალური მანევრები წარმატებულია შემთხვევების 60-90 პროცენტში [12-15].
სუპრავენტრიკულური ტაქიკარდია რომელიც რეფრაქტერულია ვაგალური მანევრების მიმართ – თუ ვაგალური მანევრი არ გარდაქმნის SVT-ს სტაბილურ ნორმალურ რითმზე, უნდა დაყენდეს IV კათეტერი რათა მოხდეს ანტიარითმული პრეპარატების შეყვანა. ადენოზინი არის პირველი რიგის პრეპარატი SVT-ის გადაუდებელი მართვისთვის, რადგან ის წარმატებით გარდაქმნის SVT-ს ნორმალურ სინუსურ რითმში დაახლოებით შემთხვევათა 75-დან 95 პროცენტში და მიუხედავად იმისა, რომ გვერდითი ეფექტები ხშირია, ისინი ძირითადად მსუბუქი და ხანმოკლეა.
პირველი რიგის თერაპია (ადენოზინი) – ადენოზინი განიხილება არჩევის მედიკამენტად ბავშვებში ЅVT მწვავე სამედიცინო კონვერტაციისთვის (ცხრილი 1 და ტალღის ფორმა 2 და ალგორითმი 1)[2,16-19].
დოზირება და მიღების წესი -შემოთავაზებულია ადენოზინის მიწოდების შემდეგ წესი:
- ჩვეულებრივი საზყისი დოზაა 0.1 მგ/კგ ინტრავენურად (IV) (მაქსიმალური დოზა 6 მგ).
- ზემოთ აღნიშნული ი/ვ შეყვანა უნდა ჩატარდეს სწრაფად, რაც შეიძლება ახლოს ცენტრალურ ცირკულაციასთან, რასაც მოჰყვება დაუყოვნებლი 5 მლ ფიზიოლოგიური ხსნარით ჩარეცხვა.
- გამოიყენება 2 შპრიცი ( ერთი ადენოზინისთვის და მეორე ფიზიოლოგიური ხსნარისთვის), რომელიც ემაგრება სტოპკოკს და გვაძლევს მედიკამენტის სწრაფად და ეფექტურად შეყვანის საშუალებას.
- პაციენტი უნდა იყოს მწოლიარე და უნდა უტარდებოდეს ეკგ-ს და არტერიული წნევის მუდმივი მონიტორინგი.
- თუ ორი წუთის განმავლობაში პასუხი არ გამოვლინდა, დოზა უნდა გაორმაგდეს (ანუ 0.2მგ/კგ IV, მაქსიმალური დოზა 12 მგ).
- დოზირების ალტერნატიული რეჟიმი შედგება საწყისი ბოლუსისაგან 0.05მგ/კგ. თუ პასუხი არ გამოვლინდა ორი წუთის განმავლობაში დოზა იზრდება 0.05 მგ/კგ-ით ყოველ 2 წთში არითმიის შეწყვეტამდე ან მაქსიმალურ დოზა 0.25-დან 0.35მგ/კგ-მდე ან ჯამური დოზაა12 მგ.
ზემოთ აღწერილი IV ინექციის პროცედურა ხელს უწყობს სწრაფ მიწოდებას გულში, რაც აუცილებელია, რადგან პრეპარატი სწრაფად მეტაბოლიზდება არააქტიურ ფორმაში ფერმენტის მიერ რომელიც მოთავსებულია წითელი უჯრედების ზედაპირზე (ერითროციტები). მედიკამენტების პერიფერიული მიწოდებისას ცენტრალურ მიწოდებასთან შედარებით მაღალი დოზებია საჭირო. [2]. ერთ კვლევაში, საშუალო ეფექტური დოზა იყო დაახლოებით 0.13მგ/კგ (დიაპაზონი 0.05-დან 0.25 მგ/კგ-მდე) . ფართო დიაპაზონი, სავარაუდოდ, ასახავს განსხვავებებს პრეპარატის შეყვანის მეთოდებში.
უკჩვენებები და სიფრთხილე.
ადენოზინის გამოყენების სიფრთხილე გულისხმობს შემდეგს:
– ადენოზინი უკუნაჩვენებია პაციენტებში, რომელთაც აქვთ უკვე არსებული მეორე ან მესამე ხარისხის ბლოკადა ან სინუსური კვანძის დაავადება[21].
-ვოლფ-პარკინსონ-უაიტის (WPW) სინდრომის მქონე პაციენტებში ადენოზინს შეუძლია გამოიწვიოს წინაგულების ფიბრილაცია, რომელიც შესაძლოა გადაიზარდოს პარკუჭოვან ფიბრილაციაში. ეს უკიდურესად იშვიათი მოვლენაა და არ ნიშნავს იმას, რომ თავიდან უნდა იქნეს აცილებული მკურნალობის ეს მეთოდი WPW-ს მქონე პაციენტებში. ამის საპირისპიროდ, ადენოზინი ითვლება პირველი რიგის მედიკამენტად SVT-ს მქონე პაციენტებისთვის, ვისაც აქვთ WPW. თუმცა კლინიცისტებმა უნდა იცოდნენ ამ პოტენციური საფრთხის შესახებ, რათა საჭიროების შემთხვევაში სწრაფად ხელმისაწვდომი იყოს რეანიმაციული ღონისძიებებისთვის საჭირო ყველა არჭურვილობა. [22].
– ადენოზინის შეყვანისას ბრონქული ასთმის მქონე პაციენტებს შეიძლება განუვითარდეთ მწვავე ბრონქოსპაზმი,[23,24], თუმცა ეს მოვლენა იშვიათია ისეთ ბავშვებში ვისაც ასთმის დიაგნოზი არ აქვთ. აღსანიშნავია რომ, ასთმა არ წარმოადგენს ადენოზინის გაკეთების უკუჩვენებას SVT-ს დროს. თუმცა აუცილებელია ექიმმა იცოდეს ამ მოვლენის შესახებ, რადგან საჭიროებისას მზად იყოს მისი მართვისთვის. ადენოზინით განპირობებული ბრონქოსპაზმის მექანიზმი გაურკვეველია, ვარაუდობენ, რომ იგი დაკავშირებულია პოხიერი უჯრედების მიერ გამოყოფილ მედიატორებთან.
– პაციენტებთან, რომელთაც ჩატარებული აქვთ გულის ტრანპლანტაცია, ადენოზინმა შეიძლება გამოიწვიოს AV ბლოკადა. ეს არის სიმპათიკური დენერვაციის შედეგი, რომელიც ზრდის სინუსური და AV კვანძის რეცეპტორების მგრძნობელობას [26]. ამგვარად, პაციენტებთან რომელთაც ჩაუტარდათ გულის გადანერგვა, სასურველია დაიწყოთ დაბალი დოზით (0.025 მგ/კგ მაქსიმალური დოზა 1.5 მგ) და საჭიროებისას მოხდეს დოზის თანდათნობითი ზრდა. რადგან, დოზირების ეს რეჟიმი უსაფრთხოა გულის გადანერგვის მქონე პაციენტებში [27].
გვერდითი მოვლენები -ადენოზინთან ხშირად ასოცირდება ისეთი გვერდითი მოვლენები, როგორიცაა სიწითლე, გულისრევა, ღებინება, დისკომფორტის გაურკვეველი შეგრძნება, გულმკერდის ტკივილი და ქოშინი, მაგრამ ჩვეულებრივ მალევე ქრება [18,20,25,28,29]. სერიოზული გვერდითი მოვლენები (მაგ. არითმიები) იშვიათია [25]. ადენოზინმა შეიძლება გამოიწვიოს წინაგულების ფიბრილაცია, თუმცა ეს ჩვეულებრივ სპონტანურად თვითლიმიტირდება [20,22]. ადენოზინი ინტრავენურად უნდა შეიყვანოთ ისეთ გარემოში, სადაც ხელმისაწვდომია შესაბამისი მონიტორინგი, გუნდი და რეანიმაციულიაღჭურვილობა (მაგ. ჟანგბადი, დეფიბრილატორი) და სადაც შესაძლებელია გვერდითი მოვლენების ადეკვატური მართვა.
- მოცემულია მულტიცენტრული ანგარიში, რომელშიც აღწერილია SVT-ს 98 ეპიზოდი. აღნიშნული პაციენტები მკურნალობდნენ გადაუდებელი დახმარების განყოფილებაში. IV ადენოზინით გვერდითი მოვლენები დაფიქსირდა 22 %-ში [25]. პაციენტებს, რომლებმაც მიიღეს მრავალჯერადი დოზა და/ან დოზები >0,2 მგ/კგ, უფრო მეტად გამოუვლინდათ არასასურველი ეფექტები მათთან შედარებით, ვინც იღებდა ერთჯერად და საერთო დოზას ≤0,2 მგ/კგ. ყველაზე გავრცელებული გვერდითი მოვლენები იყო გულისრევა ღებინება (10%), გულმკერდის არეში დისკომფორტის შეგრძნება (6 %), სიწითლე (4 %), თავის ტკივილი (3 %), ქოშინი (2 %) და ბრადიკარდია (2 %). არცერთ პაციენტს არ გამოვლენია სიცოცხლისთვის საშიში არითმია.
ეფექტურობა და მოქმედების მექანიზმი – ადენოზინის ეფექტურობა ბავშვებში SVT -ს გადაუდებელი მკურნალობისთვის დადასტურებულია რეტროსპექტრული შემთხვევების სერიებით[8,18,20,25,30-32]. ხელმისაწვდომ ანგარიშებში, მან აღმოფხვრა AVRT-ის ეპიზოდები 80-დან 95%-მდე შემთხვევაში, რაც შეადგენს SVT-ის ეპიზოდებით თითქმის სამ მეოთხედს და ეპიზოდების დაახლოებით 75%-ს SVT-ის სხვა მიზეზებში. შეწყვეტის შემდეგ SVT-ის ადრეული განმეორება ხდება შემთხვევების 25-30%-ში. მიუხედავად იმისა, რომ ბავშვებში საკმარისი კლინიკური კვლევები არ არის ჩატარებული, კვლევებმა მოზრდილებში აჩვენა, რომ ადენოზინის ეფექტურობა ЅVТ-ის შეწყვეტისას შედარებულია ვერაპამილის ეფექტურობასთან[33]. ბავშვებში, ადენოზინს ენიჭება უპირატესობა ვერაპამილთან შედარებით, მისი მოქმედების ძალიან მოკლე ხანგრძლივობის გამო და იმის გამო, რომ არსებობს რამდენიმე პარამეტრი, რომლის დროსაც ვერაპამილი არ უნდა იქნეს გამოყენებული (მაგ., ჩვილები <12 თვემდე), როგორც ეს ქვემოთ იქნება განხილული.
ადენოზინი მოქმედებს გულის უჯრედების ზედაპირზე A1 რეცეპტორებთან ურთიერთქმედებით; შედეგად მიღებული ეფექტები მოიცავს სინუსური რითმის სიხშირის შენელებას და AV კვანძოვანი გამტარობის შეფერხების ზრდას [30]. ეს წყვეტს ტაქიკარდიების რეენტრ წრეს.
ადენოზინით გამოწვეული ვაგალური სტიმულაცია ხანმოკლე და თვითლიმიტირებადია. ეფექტის დაწყება თითქმის მყისიერია: ნახევარგამოყოფის პერიოდი 5-10 წამზე ნაკლებია. აღსანიშნავია რომ, ადენოზინის ეფექტები მცირდება ისეთი მეთილქსანტინებით, როგორიცაა მაგალითად კოფეინი ან თეოფილინი.
სუპრავენტრიკულური ტაქიკარდია, რომელიც ადენოზინისადმი რეფრაქტერულია – თუ ადენოზინით ვერ ხდება SVT-ს სინუსურ რითმად გარდაქმნა, არსებობს სამი პოტენციური ახსნა:
●შესაძლოა წამალი არ იყო შეყვანილი საკმარისად სწრაფად ან საკმარისად ახლოს ცენტრალურ მიმოქცევასთან. ამ შემთხვევაში ეკგ-ს ჩანაწერი ადენოზინის მიღებისას, როგორც წესი, არ აჩვენებს რითმის შეფერხებას. შეყვანის ტექნიკის ოპტიმიზაციამ
შეიძლება გამოიწვიოს რიტმის წარმატებით შეწყვეტა.
●ტაქიარითმია შეიძლება გამოწვეული იყოს ალტერნატიული მექანიზმით, როგორიცაა წინაგულების ექტოპიური ტაქიკარდია (AET) ან წინაგულების თრთოლვა. ეკგ-ს ჩანაწერი ადენოზინის მიღების დროს შეიძლება იყოს დიაგნოსტიკურად სასარგებლო ამ შემთხვევებში (ტალღის ფორმა 3). AET და წინაგულების თრთოლვის მართვა სცილდება ამ თემის მიმოხილვის ფარგლებს. რეკომენდებულია ბავშვთა კარდიოლოგთან კონსულტაცია.
● ЅVT შეიძლება იყოს ნამდვილად რეფრაქტერული ადენოზინის მიმართ.
SVT-სთვის, რომელიც რეფრაქტერულია ადენოზინის მიმართ, IV ანტიარითმული თერაპიის არჩევანი მოიცავს პროკაინამიდს და ამიოდარონს. ვერაპამილი კიდევ ერთი ვარიანტია უფროს ბავშვებში; თუმცა მისი გამოყენება შეზღუდულია. ამ პრეპარატებს აქვთ სერიოზული გვერდითი ეფექტების პოტენციალი და ამიტომ რეკომენდებულია ბავშვთა კარდიოლოგთან კონსულტაცია.
ბეტა-ბლოკერებით თერაპია არის ი/ვ ანტიარითმული თერაპიის ალტერნატივა, თუ ЅVТ-ს მქონე პაციენტი სტაბილურია და იმყოფება მონიტორინგზე.
დიგოქსინი ჩვეულებრივ არ გამოიყენება თერაპიული დონის დაგვიანებით მიღწევის და სერიოზული ტოქსიკურობის რისკის არსებობის გამო [6]. გარდა ამისა, დიგოქსინი არ უნდა დაინიშნოს WPW სინდრომის ეჭვის შემთხვევაში, რადგან ამან შეიძლება გააძლიეროს დამატებითი გზების გამტარობა.
●პროკაინამიდი – ЅVT, რომელიც რეფრაქტერულია ადენოზინის მიმართ, შეიძლება მოიხსნას IV პროკაინამიდით. ახალშობილებში დატვირთვის დოზა 7-დან 10 მგ/კგ-მდეა და ინიშნება ინტრავენურად 30-45 წუთის განმავლობაში. ჩვილებში და უფროს ბავშვებში დატვირთვის დოზაა 10-დან 15 მგ/კგ-მდე. ამას მოჰყვება უწყვეტი IV ინფუზია, რომელიც იწყება 20 მკგ/კგ წუთში. პლაზმური დონე უნდა გაიზომოს დატვირთვის დოზის დასრულებიდან ოთხი საათის შემდეგ შემანარჩუნებელი ინფუზიის დროს.
პროკაინამიდს აქვს სერიოზული გვერდითი ეფექტების პოტენციალი, ამიტომ რეკომენდებულია ბავშვთა კარდიოლოგის კონსულტაცია. ამ მედიკამენტის მიღების შემდეგ შეიძლება განვითარდეს ნეგატიური ინოტროპული ეფექტები. გარდა ამისა, პროკაინამიდს შეუძლია გაახანგრძლივოს QT ინტერვალი და ამიტომ არ უნდა იქნას გამოყენებული სხვა პრეპარატებთან ერთად, რომლებიც ახანგრძლივებენ QT ინტერვალს.
პროკაინამიდი არის IA კლასის ანტიარითმული პრეპარატი, რომელიც მოქმედებს ძირითადად 0 ფაზის (ნატრიუმზე დამოკიდებული) დეპოლარიზაციის ინჰიბირებით და ანელებს წინაგულების გამტარობას. ადენოზინისა და ვერაპამილისგან განსხვავებით, პროკაინამიდი მოქმედებს უფრო მეტად მიოკარდიუმის გამტარობის შენელებით, ვიდრე AV კვანძში რეენტ მექანიზმის ბლოკირებით. შედეგად, პროკაინამიდი შეიძლება გამოყენებულ იქნას უსაფრთხოდ WPW სინდრომის მქონე პაციენტებში დამატებითი გზების გამტარობის პროვოცირების რისკის გარეშე. მწვავე რეფრაქტერული ЅVT-ის 40 ეპიზოდის რეტროსპექტულ კვლევაში, რომელებიც იმართებოდა ერთ დაწესებულებაში, პროკაინამიდის ეფექტურობის მაჩვენებელი უფრო მაღალი იყო ამიოდარონთან შედარებით (71% 34 პროცენტის წინააღმდეგ) [34].
●ამიოდარონი– ამიოდარონი ზოგადად წარმოადგენს სარეზერვო მედიკამენტს ისეთი ЅVΤ-სთვის, რომელიც რეფრაქტერულია სხვა აგენტების მიმართ (ადენოზინი, პროკაინამიდი) [35]. ისევე, როგორც პროკაინამიდი, იგი შეიძლება უსაფრთხოდ იქნეს გამოყენებული WPW სინდრომის მქონე პაციენტებში. აღწერილია დოზირების სხვადასხვა რეჟიმი. ჩვეულებრივ მოწოდებულია ბოლუს ინფუზია 5 მგ/კგ ინტრავენურად 20-60 წუთის განმავლობაში. თუ პასუხი არ არის, ბოლუსის დოზა მეორდება მთლიანობაში 15 მგ/კგ-მდე. თუ პაციენტი პასუხობს, ამას მოჰყვება უწყვეტი IV ინფუზია 10-დან 15 მგ/კგ დღეში.
ბავშვებში ამიოდარონის ი/ვ გამოყენებისას ხშირია გვერდითი მოვლენები და რომლებიც შეიძლება იყოს მძიმეც. რეკომენდებულია ბავშვთა კარდიოლოგთან კონსულტაცია. ხშირი გვერდითი მოვლენებია: გულისრევა და ღებინება. ასევე შეიძლება განვითარდეს ჰიპოტენზია, ბრადიკარდია, AV ბლოკადა და კარდიო-ვასკულარული უკმარისობა [35-38]. ეკგ-ს და არტერიული წნევის მონიტორინგი უნდა ჩატარდეს IV ამიოდარონის მიღებისას. ამიოდარონს და პროკაინამიდს შეუძლია გაახანგრძლივოს QT ინტერვალი და არ უნდა იქნეს მიღებული ორივე ერთად.
ამიოდარონი არის III კლასის ანტიარითმული საშუალება.
ამიოდარონის ეფექტურობა ბავშვებში ЅVT-ის მწვავე მკურნალობაში შესწავლილია რამდენიმე მცირე შემთხვევების სერიით და ერთი პროსპექტული დოზირების კვლევის კლინიკური გამოკვლევით [35,37,40,41]. ამ მოხსენებებში წარმატების მაჩვენებლები 47- 87 პროცენტის ფარგლებში მერყეობს. ფაქტორები, რომლებიც, სავარაუდოდ, გავლენას ახდენდნენ ამ კვლევებში წარმატების მაჩვენებლებზე, მოიცავს გამოყენებული ამიოდარონის დოზას, ბავშვის ასაკს (მედიკამენტის დადებითი ეფექტი ნაკლებად სავარაუდოა 12 თვემდე ასაკის ჩვილებში [41]) (რეაქციის სიხშირე ზოგადად უფრო მაღალი იყო შეზღუდულ კვლევებში. SVT-მდე კვლევებთან შედარებით, რომლებიც მოიცავდა სხვა ტაქიარითმიებს).
ერთ პროსპექტულ კლინიკურ კვლევაში, რომელშიც ჩართული იყო 61 ბავშვი (საშუალო ასაკი 4.1 წელი) უწყვეტი ტაქიარითმიით (SVТ შეადგენდა დაახლოებით ნახევარს), პასუხის დრო იყო ყველაზე სწრაფი და პასუხის მაჩვენებელი ყველაზე მაღალი იყო პაციენტებში, რომლებიც იღებდნენ მაღალი დოზებით ამიოდარონს. ანუ, 10 მგ/კგ დატვირთვის დოზით, რასაც მოჰყვება 10 მგ/კგ დღეში უწყვეტი ინფუზია) [37]. თუმცა, დოზასთან დაკავშირებული გვერდითი მოვლენები საკმაოდ ხშირი იყო, და დაფიქსირდა პაციენტების 87 პროცენტში, მათ შორის გამოვლინდა სიკვდილის ორი შემთხვევა, რომლებიც შესაძლოა დაკავშირებული იყო მედიკამენტთან. ამ მიზეზით ინტრავენური ამიოდარონი სიფრთხილით უნდა იქნეს გამოყენებული პაციენტებში, რომლებიც სხვაგვარად არიან ჰემოდინამიკურად სტაბილური და ის უნდა დაინიშნოს მხოლოდ გადაუდებელი თერაპიის პირობებში, სადაც შესაძლებელია ჰიპოტენზიისა და ბრადიკარდიის დროული მკურნალობა.
●ვერამილი -ვერაპამილი შეჰყავთ ინტრავენური ინფუზიის სახით, დოზით 0.1-დან 0.3 მგ/კგ-მდე, მაქსიმალური დოზით 10 მგ.
როგორც პირველი რიგის პრეპარატს, ადენოზინს ენიჭება უპირატესობა ვერაპამილთან შედარებით მისი მოქმედების ძალიან მოკლე ხანგრძლივობის გამო. გარდა ამისა, არსებობს მთელი რიგი პარამეტრები, რომელთან ერთადაც ვერაპამილი არ უნდა იქნეს გამოყენებული:
- 1 წლამდე ასაკის ჩვილებში, რადგან ამან შეიძლება გამოიწვიოს აპნოე, ჰიპოტენზია, ბრადიკარდია და კარდიო-ვასკულარული უკმარისობა [42,43]. ამ გართულების მექანიზმი შეიძლება იყოს ჩვილებში ცუდად განვითარებული სარკოპლაზმური ბადე, ამიტომ მიოკარდიუმის შეკუმშვა დამოკიდებულია მხოლოდ კალციუმის არხებზე.
- გულის უკმარისობის მქონე ბავშვებში [6,42].
- ცნობილი ან საეჭვო WPW სინდრომის მქონე ბავშვებში, რადგან მას შეუძლია გააძლიეროს გამტარობა დამატებით გამტარ გზაზე და გამოიწვიოს პარკუჭების ფიბრილაცია [6].
- ფართო QRS კომპლექსის ტაქიკარდიის მქონე ბავშვებში, რადგან მას შეუძლია გამოიწვიოს მძიმედ ჰემოდინამიკური მაჩვენებლების გაუარესება მათში, ვისაც აქვს პარკუჭოვანი ტაქიკარდია და არა ЅVΤ [44].
●ბეტა ბლოკატორები – SVT-ს მქონე პაციენტებში, რომლებიც თავდაპირველად არ რეაგირებენ ადენოზინზე , მაგრამ ჰემოდინამიურად სტაბილურიები არიან და მძიმე სიმპტომები არ არის გამოხატულის მოწოდებულია ბეტა ბლოკერებით თერაპია, კერძოდ IV ესმოლოლით (დამტვირთავი დოზა 100-დან 500 მკგ/კგ ერთი წუთის განმავლობაში, რასაც მოჰყვება ინფუზია 25-100 მკგ/კგ/წთ) ან პერორალური პროპრანოლოლით (0.5 მგ/კგ, როგორც ერთჯერადი დოზა), შეიძლება გამოყენებულ იქნას როგორც ალტერნატიული ან დამხმარე ფარმაკოლოგიური თერაპია იმ პირობით, რომ პაციენტი საჭიროებს უწყვეტ დაკვირვება ს სინუსური რიტმის აღდგენამდე. თუ პაციენტის რითმი ერთი საათის შემდეგ არ გამოსწორდება შეიძლება განმეორდეს ადენოზინი.
●დიგოქსინი – დიგოქსინი ჩვეულებრივ არ გამოიყენება მწვავე SVT მკურნალობისთვის, რადგან ის გამოირჩევა თერაპიული დონის გვიან მიღწევით, ვიწრო თერაპიული ზღვრით და სერიოზული ტოქსიკურობის რისკით [6]. გარდა ამისა, დიგოქსინი არ უნდა მიეცეს WPW სინდრომზე ეჭვის შემთხვევაში, რადგან მას შეუძლია გააძლიეროს დამატებითი გზის გამტარობა.
ტრანსეზოფაგური პეისინგი – ტრანსეზოფაგური პეისინგი შესაძლოა იყოს ბავშვის SVТ თერაპიის სასარგებლო დამხმარე საშუალება; თუმცა, ეს მოითხოვს ისეთი გამოცდილების მქონე კარდიოლოგებს, რომლებიც კარგად იცნობენ ტექნიკას [6]. ტექნიკა მოიცავს წინაგულების ელექტრო სტიმულაციას, სხვა თერაპიის დაწყებამდე ან სანამ ტაქიარითმია არ გაქრება [6,45]. მისი გამოყენება შესაძლებელია ტაქიკარდიის მექანიზმის დასადგენად და მის შესაჩერებლად. ეს განსაკუთრებით ღირებულია იმ ჩვილების მენეჯმენტის დროს, რომელიც რეზისტენტულნი არიან ფარმაკოლოგიური თერაპიის მიმართ ან ისეთი SVT-ს მკურნალობისთვის რომელიც განუწყვეტელი რეციდივით მიმდინარეობს, რადგან ის შეიძლება განმეორებით იქნეს გამოყენებული ფარმაკოლოგიური კარდიოვერსიების პოტენციური გვერდითი ეფექტების დამატებითი ზემოქმედების გარეშე. ერთ კვლევაში, რომელშიც მონაწილეობდა 63 პაციენტი (ძირითადად მოზრდილები), ტრანსეზოფაგური პეისინგის გამოყენებამ წარმატებით აღმოფხვრა SVT-ს ყველა შემთხვევა, გარდა ერთი შემთხვევისა [45]. თუმცა ტრანსეზოფაგური პეისინგი მოითხოვს სპეციალიზებულ პერსონალს და აღჭურვილობას. შეიძლება საჭირო გახდეს ბავშვის სედაცია, რადგან პროცედურა მეტად არასასიამოვნოა.
შეფასება მწვავე ეპიზოდის შემდეგ
მწვავე ეპიზოდის დასრულების შემდეგ უნდა ჩატარდეს ელექტროკარდიოგრაფია (ეკგ) და ექოკარდიოგრაფია. ეკგ მიიღება ვოლფ-პარკინსონ-უაიტის (WPW) სინდრომის მტკიცებულების აღმოსაჩენად (ფართო QRS კომპლექსის არსებობა “დელტა ტალღით”) (ტალღის ფორმა 1).
ექოკარდიოგრაფია უნდა ჩატარდეს გულის სტრუქტურული დაავადების შესაფასებლად, რადგან ЅVТ შეიძლება ასოცირებული იყოს გულის თანდაყოლილ დაავადებასთან [32].
რეფერალი
ჩვილები და ბავშვები ელექტროკარდიოგრამაზე (ECG) წინასწარი აგზნებით ან დადასტურებული SVT-ით გადამისამართებულ უნდა იქნენ პედიატრ კარდიოლოგ/ელექტროფიზიოლოგთან, რათა მოახდინონ დიაგნოსტიკური შეფასება და განიხილონ რისკის შეფასება და მართვის ვარიანტები.
გადაუდებელი დახმარება საჭოროა ბავშვებისთვის, რომლებსაც აღენიშნებათ SVT-თან ასოცირებული რომელიმე ქვემოთ ჩამოთვლილი:
●სინკოპე
●გულის უკმარისობა
●უწყვეტი ტაქიკარდია
●სხვა მოვლენები, რაც ასოცირდება გულის პათოლოგიასთან (მაგ. პარკუჭის ფუნქციის დათრგუნვა ექოკარდიოგრამაზე)
უმეტეს სხვა გარემოებებში, მიმართვა შეიძლება გაკეთდეს არჩევითად ამბულატორიულ საფუძველზე.
მკურნალობა სუპრავენტრიკულური ტაქიკარდიის რეციდივების პროფილაქტიკისთვის
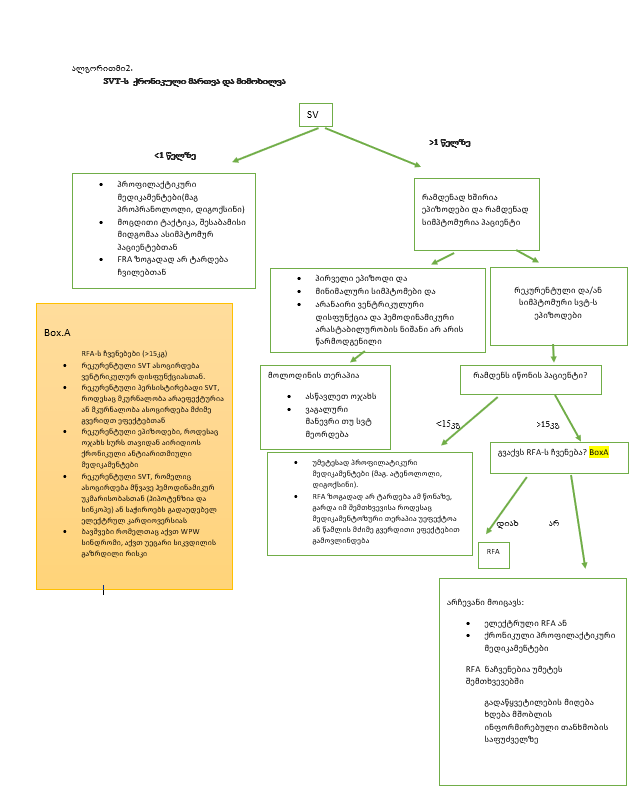
SVT-ის ქრონიკული მართვის ვარიანტები მოიცავს მოლოდინის მართვას, ფარმაკოლოგიურ თერაპიას და კათეტერის აბლაციას. თითოეულ მიდგომას აქვს დადებითი და უარყოფითი მხარეები. კონკრეტული მიდგომა უნდა იყოს მორგებული ინდივიდუალურად პაციენტზე ასაკისა და სიმპტომების სიმძიმის მიხედვით (ალგორითმი 2).
ჩვილები <1 წელზე — ЅVΤ-ის მქონე ჩვილებისთვის შემოთავაზებულია პროფილაქტიკურ ფარმაკოლოგიური თერაპია პროპრანოლოლით. მოსალოდნელი მენეჯმენტი არის ალტერნატიული ვარიანტი პირველი ეპიზოდის შემდეგ იმ შემთხვევაში, თუ ჩვილი ასიმპტომურია და აქვს ნორმალური პარკუჭის ფუნქცია. ზოგადად მოლოდინის თერაპიასთან შედარებით საწყისი ფარმაკოლოგიური თერაპია უპირატესია , რადგან ჩვილები ვერ აღნიშნავენ პალპიტაციას და, შესაბამისად, SVT-ის რეციდივების გამოვლენა შეიძლება შეფერხდეს მაშინაც კი, თუ მშობლებს დაევალებათ გულისცემის მონიტორინგი. ამრიგად, ჩვილებს უფრო ხშირად უვითარდებათ გულის უკმარისობის ნიშნები და სიმპტომები, ვიდრე უფროს ბავშვებს [6]. ჩვილებში კათეტერის აბლაცია ჩვეულებრივ არ არის გამოსავალი, რადგან გართულებების რისკი მეტისმეტად მაღალია.
●პროფილაქტიკური მედიკამენტები (სასურველია) – სასურველია მკურნალობა ბეტა ბლოკატორით, როგორც პირველი რიგის აგენტით ჩვილებში SVT ქრონიკული მართვისთვის. ეს ძირითადად ეფუძნება ბეტა ბლოკატორების გვერდითი ეფექტების პროფილს, რომელიც ზოგადად უფრო ხელსაყრელია, ვიდრე სხვა ანტიარითმული პრეპარატების შემთხვევაში. დაკვირვების მონაცემები, კლინიკური გამოცდილება და ერთი რანდომიზებული კლინიკური კვლევა მხარს უჭერს ამ პრაქტიკას [46-50]. 12 თვემდე ჩვილებისთვის რეკომენდებული ბეტა ბლოკატორი არის პროპრანოლოლი (2-დან 4 მგ/კგ დღეში პერორალურად დაყოფილი ოთხ დოზად).
თერაპიის ხანგრძლივობა ახალშობილებში <1 წელი ცვალებადია. მულტიცენტრულ კოჰორტულ კვლევაში 278 ჩვილი, რომლებიც მკურნალობდნენ ექვსი თვის ან ერთი წლის განმავლობაში, SVT-ის რეციდივის სიხშირეში განსხვავება არ დაფიქსირებულა ერთი წლის განმავლობაში (12 პროცენტი ორივე ჯგუფში) [51]. რეციდივის დამოუკიდებელი რისკის ფაქტორები მოიცავდა კომბინირებულ ანტიარითმიულ რეჟიმებს, WPW-ს და ასაკს > 1 თვე პრეზენტაციაზე.
● მოსალოდნელი მენეჯმენტი- წარმოადგენს ვარიანტს ჩვილებისთვის, რომლებიც უსიმპტომოები არიან, არ აქვთ კარდიოპულმონარული უკმარისობა ან პარკუჭოვანი დისფუნქცია. თუმცა ეს მიდგომა ჩვილებში არც ისე ხშირად გამოიყენება, რადგან SVT-ის რეციდივები ამ ასაკობრივ ჯგუფში უფრო რთულია სხვა ასაკის წარმომადგენლებთან შედარებით. თუ არჩეულ იქნება ეს მიდგომა, ჩვილებს აკონტროლებენ 24 სთ-ის განმავლობაში და მშობლებს მიეცემათ შესაბამისი განათლება აღნიშნულ საკითხთან დაკავშირებით.
● 1 წელზე მცირე ასაკის ბავშვები -ამ ასაკის ბავშვებისათვის მართვა დამოკიდებულია სიმპტომების სიმძიმეზე და ბავშვის წონაზე. (ალგორითმი 2)
პირველი ეპიზოდი, მინიმალური სიმპოტომები- ჩვენ ჩვეულებრივ ვმართავთ პაციენტებს, მოსალოდნელი მენეჯმენტით თუ სვტ არის პირველად აღმოცენებული, არ აღინიშნება სიმპტომები ან წარმოგენილია მინიმალური სიმპტომატიკა ჰემოდინამიკური არასტაბილურობის ან პარკუჭოვანი დისფუნქციის გარეშე. ასეთი პაციენტი საჭიროებს დაკვირვებას შემდეგი 24 სთის განმავლობაში. აუცილებელია ვასწავლოთ მშობელს როგორ შეამოწმოს გულისცემა და ასევე ვასწავლოთ ვაგალური მანევრების გამოყენება (მაგ. ყინულის ტომრის წასმა სახეზე, ვალსალვას მანევრის შესრულება. თავით ქვემოთ პოზიციის ჩატარების ტექნიკა. იხ/ „ვაგალური მანევრები ზემოთ).
ამ მიდგომის რაციონალურობა მდგომარეობს იმაში რომ ზოგიერთ პაციენტს (განსკუთრებით ვისი ასაკიც 5 წელზე ნაკლებია) შეიძლება გახანგრძლივდეს, და არ დასჭირდეს ქრონიკული თერაპია, რომელიც არაერთ გვერდით მოვლენასთან არის ასოცირებული. როგორც უკვე აღინიშნა ეს მიდგომა ნაკლებად ხშირად გამოიყენება ჩვილებში, რადგან SVT-ს რეციდივები ამ ასაკობრივ ჯგუფში უფრო რთული გამოსავლენია.
მორეციდივე და/ან სიმპტომური სუპრავენტრიკულური ტაქიკარდიის ეპიზოდები – ბავშვებისთვის, რომლებსაც აქვთ მორეციდივე და/ან სიმპტომატური ЅVТ ეპიზოდები, რეკომენდებულია ჩარევა შემდგომი რეციდივების თავიდან ასაცილებლად. ინტერვენციის არჩევანი დამოკიდებულია ბავშვის წონაზე; რადიოსიხშირული აბლაცია (RFΑ) ჩვეულებრივ მოიაზრება იმ პაციენტებისთვის ≥15 კგ, რადგან მცირე წონის ბავშვებში RFΑ გართულებების რისკი მაღალია.
●ბავშვები <15 კგ – ჩვილებისა და მცირეწლოვანი ბავშვებისთვის, რომელთა წონა 15 კგ-ზე ნაკლებია და აქვთ SVT ხშირი ეპიზოდები ან რომლებიც სიმპტომატური ხდება იშვიათი ეპიზოდების დროს, ნაჩვენებია პროფილაქტიკურ სამედიცინო თერაპია. სამედიცინო მკურნალობის მიზანია SVT-ის ეპიზოდების პრევენცია ან სიმპტომების შემცირება რეციდივის დროს. ასეთი ბავშვებისათვის გამოიყენება გრძელვადიანი დღიური მედიკამენტები ბეტა-ბლოკერთან ერთად. ჩვეულებრივ 1 წელზე უფროსი ასაკის ბავშვებში, გამოიყენება ხანგრძლივი მოქმედების ბეტა ბლოკატორები, როგორიცაა ატენოლოლი ან ნადოლოლი. ორივე ინიშნება დოზით 1- 2 მგ/კგ დღეში პერორალურად.
მკურნალობის სხვა ფორმაა „პულსირებული“ ან „კოქტეილ“ თერაპია, რომლის დროსაც პაციენტი იღებს ანტიარითმიულ პრეპარატს მხოლოდ ЅVT ეპიზოდის დროს, რათა შეწყდეს არითმია [6,52,53]; თუმცა ეს მიდგომა ფართოდ გავრცელებული არ არის.
●ბავშვები ≥15 კგ – ბავშვებში, რომელთა წონაა ≥15 კგ, რეკომენდირებულია RFΑ-ს და არა ქრონიკული ანტიარითმული მედიკამენტებით თერაპია. RFΑ არის ეფექტური მკურნალობა SVT-ის უმეტესობისთვის და ის თავიდან აგვაცილებს ქრონიკული ფარმაკოლოგიური თერაპიის არასასურველ ეფექტებს.
საწყისი მედიკამენტური თერაპიის წარუმატებლობა – ფარმაკოლოგიური თერაპიით მართული პაციენტებისთვის, რომლებიც ვერ აღწევენ SVT-ის ადეკვატურ კონტროლს პირველი რიგის თერაპიით, მეორე რიგის თერაპიის ვარიანტები მოიცავს ფლეკაინიდს, სოტალოლს და ამიოდარონს[54-60].
RFA არის კიდევ ერთი ვარიანტი ბავშვებისთვის, რომლებიც არ პასუხობენ თავდაპირველ სამედიცინო თერაპიას და ეს არის არჩევის მიდგომა ბავშვებისთვის წონით ≥15 კგ. RFΑ ჩვეულებრივ არ ტარდება 15 კგ-ზე ნაკლები წონის ბავშვებში გარდა იმ შემთხვევისა, როდესაც SVT არის რეფრაქტერული სამედიცინო თერაპიის მიმართ ან პაციენტი არატოლერანტულია ფარმაკოლოგიური თერაპიის გვერდითი ეფექტების მიმართ.
ერთ კვლევაში, ფაქტორები, რომლებიც იუწყებოდნენ ცუდ პასუხს საწყის თერაპიაზე, მოიცავდა მცირე ასაკში მანიფესტაცია (<1 თვე), ავადობის დროს პარკუჭის დისფუნქციის განვითარებას და დამხმარე გზის ნელი რეტროგრადული გამტარობის არსებობას.[61]
პრევენციული თერაპიის მკურნალობის მეთოდები
ЅVТ-ის გრძელვადიანი კონტროლისთვის მკურნალობის ვარიანტები მოიცავს ფარმაკოლოგიურ თერაპიას და რეენტრის გზის აბლაციას. მიდგომა მორგებულია ინდივიდუალურად პაციენტზე ასაკისა და სიმპტომების სიმძიმის მიხედვით, როგორც ეს შეჯამებულია და აღწერილია ზემოთ (ალგორითმი 2).
ფარმაკოლოგიური თერაპია
პირველი რიგის პროფილაქტიკური თერაპია (ბეტა ბლოკატორი) – პაციენტების უმეტესობისთვის, რომლებსაც ესაჭიროებათ ფარმაკოლოგიური პროფილაქტიკა ქრონიკული SVT მართვისთვის, რეკომენდებულია ბეტა ბლოკატორის და არა დიგოქსინი ან სხვა ანტიარითმიული პრეპარატის გამოყენება. უპირატესობის მინიჭება დიდწილად ეფუძნება ბეტა-ბლოკერების უფრო ნაკლები გვერდითი ეფექტების პროფილს სხვა ანტიარითმიულ საშუალებებთან შედარებით.
ბეტა ბლოკატორის არჩევანი დამოკიდებულია ასაკზე:
●ჩვილები – ჩვილებში გამოიყენება პროპრანოლოლი (2-4 მგ/კგ დღეში ორალურად დაყოფილი ოთხ დოზად)
●უფროსი ბავშვები – უფროს ბავშვებში გამოიყენება უფრო ხანგრძლივი მოქმედების ბეტა ბლოკატორი, როგორიცაა ატენოლოლი ან ნადოლოლი (ორივე მიიღება დოზით 1- 2 მგ/კგ დღეში პერორალურად).
ბეტა ბლოკატორების გვერდითი მოვლენები მოიცავს ჰიპოტენზიას, ბრადიკარდიას, ემოციურ აშლილობას და კოშმარებს.
ბეტა ბლოკერებით თერაპიამ ზოგადად ჩაანაცვლა დიგოქსინი, რომელიც ჩვეულებრივ გამოიყენებოდა ЅVΤ-ის სამკურნალოდ წარსულში, რადგან ბეტა ბლოკერები უკეთ იტანენ და არ საჭიროებენ წამლების თერაპიულ მონიტორინგს. SVT-ის განმეორების სიხშირე ჩვილებში, რომლებიც მკურნალობენ პროპრანოლოლით, როგორც ჩანს, შედარებულია დიგოქსინთან [49,50]. მულტიცენტრულ კლინიკურ კვლევაში, რომელშიც ჩართული იყო 71 ჩვილი, ЅVΤ ნამკურნალები იყო დიგოქსინით და პროპანოლოლით, ЅVT განმეორების სიხშირე მსგავსი იყო ორივე ჯგუფში (33 და 34 პროცენტი, შესაბამისად) [49]. არცერთი სიკვდილი და არც სერიოზული გვერდითი მოვლენა არ დაფიქსირებულა საკვლევ მედიკამენტებთან.
პედიატრიული ჯანმრთელობის საინფორმაციო სისტემის (PHIS) მონაცემთა ბაზიდან (2003-2013) რეტროსპექტულ კვლევაში, რომელიც მოიცავდა 851 ჩვილს 1 წლამდე (44 პროცენტი იყო <30 დღის), ჰოსპიტალიზირებული იყო SVT-ის მართვისთვის, 73 პროცენტს დაუნიშნეს ანტიარითმული თერაპია. [62].
ყველაზე ხშირად პაციენტები მკურნალობდნენ ერთჯერადად პროპრანოლოლით (44%), რასაც სიხშირით მოჰყვებოდა დიგოქსინი (24%) და შემდეგ ამიოდარონი (16%); რამოდენიმე მედიკამენტით თერაპია გამოიყენებოდა პაციენტების 10 პროცენტში. SVT-ს რემისიის მაჩვენებელი საავადმყოფოდან გაწერიდან 30 დღის განმავლობაში დაბალი იყო ამ კოჰორტაში (5 პროცენტი) და მსგავსი იყო პაციენტებში, რომლებიც გაეწერნენ პროპრანოლოლით სხვა აგენტებთან შედარებით ან იმ პაციენტებთან შედარებით ვისაც არ დაენიშნათ არანაირი თერაპია.
სხვა კვლევამ PHIS მონაცემთა ბაზის გამოყენებით (2004 წლიდან 2015 წლამდე) გამოავლინა ≤2 დღის ასაკის 1339 ახალშობილი, რომლებიც მკურნალობდნენ ანტიარითმული მედიკამენტ(ებ)ით ЅVΤ ან სხვა არავენტრიკულური დისრითმიის გამო [63]. პროპრანოლოლის გამოყენება სტაბილურად გაიზარდა კვლევის პერიოდში, ხოლო დიგოქსინის გამოყენება შემცირდა.
საკითხის ანალიზის დროს, გამოვლინდა რომ სიკვდილიანობა უფრო დაბალი იყო პაციენტებში, რომლებიც მკურნალობდნენ პროპანოლოლით, შედარებით იმ პაციენტებთან რომლებიც მკურნალობდნენ დიგოქსინით. თუმცა, დასკვნა არ იყო მნიშვნელოვნად გადამწყვეტი (შანსების კოეფიციენტი 0.64, 95% CI 0.28-1.41).
287 ახალშობილთა ერთცენტრიან კვლევაში (საშუალო ასაკი 17 დღე), პერორალური პროპრანოლოლის მაღალი დოზით თერაპია (საშუალო დოზა 3.6 მგ/კგ დღეში) აკონტროლებდა SVT პაციენტების 67 პროცენტს [46]. ამ კოჰორტაში, ЅVT-ის კონტროლი შენარჩუნებული იყო ამბულატორიული თერაპიის დროს პაციენტების დაახლოებით 90 პროცენტში, რომლებიც აგრძელებდნენ მკურნალობას. მხოლოდ ერთ პაციენტს განუვითარდა კლინიკურად მნიშვნელოვანი გვერდითი მოვლენა (ბრადიკარდია) თერაპიის დაწყებისას, რის გამოც მედიკამენტის მიცემა შეწყდა. პაციენტებს, რომლებმაც ვერ შეძლეს მონოთერაპია პროპანოლოლით უფრო მეტად აღენიშნებოდათ თანდაყოლილი გულის დაავადება ან ვოლფ-პარკინსონ-უაიტის (WPW) სინდრომი და ისინი გადაიყვანეს სოტალოლზე (n = 53), დიგოქსინზე (n = 12), ამიოდარონზე (n = 7), ფლეკაინიდზე (n = 7), ან კომბინირებული თერაპიაზე.
მეორე რიგის აგენტები – პაციენტებისთვის, რომლებიც ვერ აღწევენ ЅVΤ-ის ადეკვატურ კონტროლს ბეტა-ბლოკერებით თერაპიით, მეორე რიგის ფარმაკოლოგიური თერაპიის ვარიანტები მოიცავს ფლეკაინიდს, სოტალოლს და ამიოდარონს[54-60]. ვერაპამილი არ უნდა იქნას გამოყენებული 1 წლამდე ასაკში და WPW სინდრომის მქონე ბავშვებში. ეს მდგომარეობები ზღუდავს ვერპამილის, როგორც მეორე რიგის აგენტის გამოყენებას პედიატრიულ პაციენტებში. დიგოქსინი იშვიათად გამოიყენება ЅVT-ს სამკურნალოდ თანამედროვე პრაქტიკაში. იგი ჩვეულებრივ გამოიყენებოდა წარსულში, მაგრამ ის შეიცვალა სხვა უფრო ეფექტური და უფრო მეტად ტოლერანტული საშუალებებით.
მეორე რიგის წამლები შეიძლება ეფექტური იყოს მონოთერაპიით ან კომბინაციაში. მათი ეფექტურობა ბავშვებში რეფრაქტორული SVT-ის სამკურნალოდ დადასტურებულია მცირე შემთხვევების სერიებით [54-60].
ამ პრეპარატების გვერდითი ეფექტები ზოგადად უფრო სერიოზულია, ვიდრე ბეტა ბლოკატორების შემთხვევაში. თითოეული აგენტის გვერდითი მოვლენები უფრო დეტალურად განიხილება ცალკე:
●ფლეკაინიდი – ფლეკაინიდი ზოგადად კარგად აიტანება, მაგრამ ის შეიძლება იყოს პროარითმული და ასოცირდება სხვადასხვა არაკარდიულ გვერდით მოვლენებთან, მათ შორის თავბრუსხვევასთან, დაბინდულ მხედველობასთან, თავის ტკივილთან და გულისრევასთან.
●სოტალოლი – სოტალოლი ზოგადად კარგად აიტანება. გულისმიერი ძირითადი გვერდითი მოვლენებია ბრადიკარდია და პროარითმია. არაკარდიული გვერდითი მოვლენები შეიძლება მოიცავდეს დაღლილობას, სისუსტეს და თავბრუსხვევას.
●ამიოდარონი – ამიოდარონთან დაკავშირებული გვერდითი ეფექტები შეჯამებულია ცხრილში და განხილულია ცალკე (ცხრილი 2).
არსებობს ЅVΤ-ის მქონე ბავშვებში რამდენიმე მონაცემი ამ პრეპარატების შედარების შესახებ. ხელმისაწვდომი შემთხვევების სერიებში ამ აგენტების წარმატების მაჩვენებელი მერყეობდა 20-დან 100 პროცენტამდე [54-60]. შემთხვევების სერიაში 78 ჩვილი რეფრაქტერული SVT-ით (დაახლოებით ნახევარს ჰქონდა გულის თანდაყოლილი დაავადება), 90 პროცენტმა მიაღწია ЅVΤ-ს კონტროლს სოტალოლის მაღალი დოზით თერაპიით (საშუალო დოზა 152 მგ/მ2 დღეში, დიაპაზონი 65-დან 244 მგ/მ. მ2 დღეში) [64].
არცერთ პაციენტს არ გამოვლენია კლინიკურად მნიშვნელოვანი QT-ინტერვალის გახანგრძლივება ან პროარითმია. სხვა რეტროსპექტულ კვლევაში 33 ახალშობილზე SVT-ით (ყველა შემთხვევა გამოწვეული იყო ატრიოვენტრიკულური [AV] რეენტრ ტაქიკარდიით), რომლებიც თავდაპირველად მკურნალობდნენ დიგოქსინით, 58 პროცენტს ჰქონდა მრავლობითი რეციდივები დიგოქსიზე და გადავიყვანეს ფლეკაინიდზე, რომელიც კარგად მართავდა ЅVT-ს ყველა შემთხვევაში [54] . მორეციდივე ЅVТ 74 ბავშვის შემთხვევაში, რომლებიც მკურნალობდნენ ორალური ფლეკაინიდით (n = 47) ან პერორალური ამიოდარონით (n = 27), პაციენტების წილი, რომლებმაც მიაღწიეს სრულ ან ნაწილობრივ წარმატებას, მსგავსი იყო ორივე ჯგუფში (81 და 78 პროცენტი, შესაბამისად) [60]. იმ ხუთი ბავშვისგან, რომლებიც წარუმატებლად იმართნენ და შემდგომში გადავიდნენ ფლეკაინიდზე, ოთხ პაციენტს ჰქონდა მკურნალობაზე წარმატებული შედეგი. გვერდითი მოვლენები ძირითადად უმნიშვნელო იყო და ნაკლებად ხშირი იყო ფლეკაინიდით მკურნალობისას, ამიოროდარონთან შედარებით (9 წინააღმდეგ 22 პროცენტისა).
კომბინირებული თერაპია ძირითადად გნიხილება იმ პაციენტებთან, რომლებსაც აქვთ ძნელად კონტროლირებადი არითმია და საჭიროებს განსაკუთრებულ მონიტორინგს პროარითმული ეფექტებისთვის [58]. მედიკმენტების კომბინაციების გამოყენება ცვალებადია ინდივიდუალურად დაწესებულებების და პაცეინტის მიხედვით.
კათეტერით აბლაცია – კათეტერით აბლაცია წარმოადგენს SVT-ს საბოლოო თერაპიას. როგორც უკვე იყო განხილული, ყველაზე გამოცდილ ცენტრებში წარმატების მაჩვენებელი >90 პროცენტია და გართულებების სიხშირე დაბალია. თუმცა, გართულებების რისკი იზრდება ახალშობილებსა და მცირეწლოვან ბავშვებში, რაც ზღუდავს მის გამოყენებას ამ პოპულაციაში.
●ჩვენებები – რეკომენდებულია რადიოსიხშირული აბლაცია (RFA) ბავშვებისთვის, რომლებიც ≥15 კგ არიან და ან რომლებსაც აქვთ SVT-ის ხშირი ეპიზოდები, ან ხდება მკვეთრად სიმპტომური იშვიათი ეპიზოდების დროს (ალგორითმი 2). ასეთი პაციენტებისთვის არჩევითი RFA-ს ძირითადად უპირატესობას ანიჭებენ ქრონიკულ ანტიარითმიულ თერაპიასთან შედარებით, რადგან ის თავიდან გვაცილებს ფარმაკოლოგიური თერაპიის არასასურველ ეფექტებს. თუმცა მკურნალობის არჩევანი უნდა ეფუძნებოდეს ოჯახთან ერთად მიღებულ გადაწყვეტილებას.
UpToDaTe ეთანხმება RFA-ს შემდეგ კლინიკურ ჩვენებებს, რომლებიც შემუშავებულია პედიატრიული და თანდაყოლილი ელექტროფიზიოლოგიის საზოგადოების (PACES) და გულის რითმის საზოგადოების (HRS) მიერ:
- დოკუმენტირებული მორეციდივე ან მუდმივი ЅVΤ, რომელიც ასოცირდება პარკუჭების დისფუნქციასთან (პაციენტებში ≥15 კგ)
- დოკუმენტირებული მორეციდივე ან მუდმივი SVT, როდესაც მედიკამენტური თერაპია არაეფექტურია ან დაკავშირებულია მძიმე გვერდით ეფექტებთან (ნებისმიერი წონის პაციენტებში)
- დოკუმენტირებული მორეციდივე ან მუდმივი ЅVТ (პაციენტებში ≥15 კგ), როდესაც ოჯახს სურს თავიდან აიცილოს ქრონიკული ანტიარითმული მედიკამენტები
- დოკუმენტირებული მორეციდივე SVТ, რომელიც ასოცირდება მწვავე ჰემოდინამიკურ არასტაბილურობასთან (ჰიპოტენზია ან სინკოპე) ან რომელიც საჭიროებს სასწრაფო სამედიცინო დახმარებას ან ელექტრულ კარდიოვერსიას (პაციენტებში ≥15 კგ) .
დამატებითი ჩვენებები სცილდება ამ თემის ფარგლებს და ეფუძნება სხვა კლინიკურ პრეზენტაციებს და ელექტროფიზიოლოგიურ (EP) ტესტებს, როგორც დეტალურადაა აღწერილი PACES/HRS შეთანხმების განცხადებაში[65].
მიუხედავად იმისა, რომ არსებობს მონაცემები, რომლებიც ადასტურებენ RFA-ს ეფექტურობას მცირეწლოვან ბავშვებში [66-68], რეკომენდებულია თავიდან იქნეს აუცილებული პროცედურა 15 კგ-ზე ნაკლები წონის პაციენტებში, გარდა იმ შემთხვევისა, როდესაც პაციენტი არ ემორჩილება მედიკამენტოზურ თერაპიას ბავშვებში გართულებების გაზრდილი რისკის გამო [69,70] .
RFA-ს როლი უსიმპტომო პაციენტებში WPW ნიმუშით ელექტროკარდიოგრამაზე რჩება საკამათო. ეს საკითხი ცალკე განიხილება.
●ტექნიკა – RFA ტარდება ინვაზიური EP (ელექტროფიზიოლოგიური კვლევა) კვლევის ფარგლებში. სედაცია უზრუნველყოფილია პროცედურის დროს დისკომფორტის შესამცირებლად და პაციენტის მოძრაობის თავიდან ასაცილებლად; ზოგადი ანესთეზია ხშირად საჭიროა მცირეწლოვანი ბავშვებისთვის [6,65].
EP კვლევა ტარდება ორ ეტაპად:
• ЅVT-ის მექანიზმის დადგენა და დამატებითი გზის ლოკალიზაციის განსაზღვრა – ამ ეტაპზე ტრანსვენური კათეტერის ელექტროდების ჩასმა და მანიპულირება ხდება პეისინგისა და ჩაწერისთვის. ჩანაწერების ნიმუში, რომელიც მიღებულია ნორმალური სინუსური რიტმის დროს, პეისინგის საპასუხოდ და SVΤ-ის დროს (თუ შესაძლებელია მისი გამოწვევა) გამოიყენება ЅVТ მექანიზმის საბოლოო დიაგნოზის დასადგენად.
• გამტარი გზის აბლაცია – მას შემდეგ, რაც SVT მექანიზმი დადგინდება და დამხმარე გზა ან AV კვანძოვანი გზის ლოკალიზაცია განისაზღვრება, გამოიყენება მოდიფიცირებული კათეტერი, რომელსაც შეუძლია მიიტანოს რადიოსიხშირული ენერგია, რომელიც ზემოქმედებს მიოკარდიუმის ქსოვილზე და აღმოფხვრის გამტარ გზას. ენერგიის სტანდარტული წყარო, რომელიც გამოიყენება კათეტერის აბლაციისთვის, არის რადიოსიხშირული დენი. კრიოენერგია წარმოადგენს ალტერნატივას, რომელიც გამოიყენებოდა ბავშვებში ატრიოვენტრიკულური კვანძოვანი რეენტრ ტაქიკარდიით (ΑVΝRT) [71-74]. ამის საპირისპიროდ, პირდაპირი დენის აბლაცია, რომელიც გამოიყენებოდა RFΑ-ს განვითარებამდე, ასოცირდებოდა გართულებების მაღალ სიხშირესთან და აღარ გამოიყენება კლინიკურად [75,76].
კათეტერის აბლაციის ტექნიკური დეტალები უფრო დეტალურად განიხილება ცალკე.
●ეფექტურობა – ბავშვებში RFA-ს ხელმისაწვდომ ანგარიშებში, მწვავე პროცედურული წარმატების მაჩვენებლები მერყეობდა 80-დან 100 პროცენტამდე, ხოლო რეციდივები წარმოდგენილ იყო 5-20 პროცენტ შემთხვევებში[32,69,70,77-80]. თანამედროვე ეპოქაში პედიატრიული RFΑ-ს წარმატების მაჩვენებელი უმეტეს გამოცდილ ცენტრებში არის >90 პროცენტი და გართულებები ხდება შემთხვევების <5 პროცენტში.
RFA-ს წარმატება ნაწილობრივ დამოკიდებულია SVT მექანიზმზე და დამატებითი გზების მდებარეობაზე. მულტიცენტრული პედიატრიული RFA რეესტრიდან ჩატარებულ კვლევაში, რომელშიც ჩართული იყო >2500 პაციენტი (1800 დამხმარე გზებით, 800 AVNRT-ით), წარმატების მაჩვენებელი იყო 94 პროცენტი დამატებითი გზების მქონე პაციენტებისთვის და 97 პროცენტი AVNRT-ის მქონე პაციენტებისთვის [78]. დამხმარე გზების მქონე პაციენტებისთვის წარმატების ყველაზე მაღალი მაჩვენებელი დაფიქსირდა ბავშვებში, რომლებსაც აქვთ დამატებითი გზები მარცხენა კედელში (98%), მაშინ როდესაც წარმატების მაჩვენებელი გარკვეულწილად დაბალი იყო პაციენტებისთვის, რომლებსაც აქვთ მარჯვენა კედლის, მარჯვენა ძგიდის და მარცხენა ძგიდის დამატებითი გზები (90, 89 და 88 პროცენტი, შესაბამისად).
● გართულებები – პროცედურული გართულებები, რომლებიც დაკავშირებულია RFA-სთან, იშვიათია, გვხვდება შემთხვევების <5 პროცენტში [70,78,79,81,82]. MAP-IT რეესტრის მოხსენებაში, რომელიც მოიცავს 1417 პროცედურებს, რომლებიც ჩატარდა ჩრდილოეთ ამერიკის 12 ცენტრში 2014-დან 2016 წლამდე, მოხსენებული გართულებების მაჩვენებელი იყო 3,6 პროცენტი [82]. კვლევების უმეტესობა, რომელიც აფასებს RFΑ-ს გართულებებს, იყენებს საკმაოდ ფართო განმარტებას, მათ შორის აღწერს მთავარ, მცირე და გარდამავალ გვერდით მოვლენებს.
რეესტრის ადრეულ კვლევებში, EP კვლევასთან დაკავშირებული გართულებები დაფიქსირდა პროცედურების 2.9 პროცენტში და აბლაციასთან დაკავშირებული გართულებები 3.2 პროცენტში [70,78]. EP კვლევასთან დაკავშირებული ყველაზე გავრცელებული გართულება იყო ჰემატომა კათეტერის ჩადგმის ადგილზე (1.4 პროცენტი). აბლაციასთან დაკავშირებული ყველაზე გავრცელებული გართულება იყო AV ბლოკადა (0.7-დან 1.3 პროცენტამდე), რომელიც აღინიშნებოდა მხოლოდ პაციენტებში ΑVNRΤ ან სეპტალური დამატებითი გზებით და არ განვითარებულა პაციენტებში, რომლებსაც უტარდებოდათ იმ დამხმარე გზების აბლაცია, რომლებიც მდებარეობს მარჯვენა ან მარცხენა კედელში. სხვა გართულებები მოიცავდა ჰისის კონის მარჯვენა ტოტის ბლოკირებას (0,7 პროცენტი), პერფორაციას და/ან პერიკარდიუმის გამონაჟონს (0,1-0,7 პროცენტი), მხრის წნულის დაზიანებას (0,2-დან 0,3 პროცენტამდე), სარქვლოვან რეგურგიტაციას (0,3 პროცენტი), ემბოლიას (0-0,2 პროცენტი), და პნევმოთორაქსის (0-დან 0,2 პროცენტამდე). ადრეულ კოჰორტაში დაფიქსირდა პროცედურებთან დაკავშირებული ოთხი სიკვდილის შემთხვევა (0.1 პროცენტი) [70] და არცერთი სიკვდილის შემთხვევა მოგვიანებით კოჰორტაში [78].
გართულებების რისკის ფაქტორები, ძირითადად, პედიატრიული RFΑ რეესტრის კვლევებში მოხსენებულ გამოცდილებაზე დაფუძნებული 1990-იანი წლებიდან 2000-იანი წლების დასაწყისამდე მოიცავს პაციენტის ასაკს <4 წელზე, პაციენტის წონას <15 კგ და ცენტრის გამოუცდელობას პროცედურასთან მიმართებაში/ [69,70,83,84] .
ქირურგიული თერაპია – მიუხედავად იმისა, რომ ქირურგიული აბლაცია ეფექტური მკურნალობაა წამლისადმი რეფრაქტერული SVT-სთვის, ის დიდწილად შეიცვალა RFΑ-ით. თანამედროვე ეპოქაში ოპერაცია დაშვებულია იმ იშვიათ შემთხვევაში, როდესაც არითმია რეფრაქტერულია RFΑ-ს მცდელობის მიმართ და იმ შემთხვევაში, როდესაც სხვა კარდიოქირურგიული პროცედურა იგეგმება პაციენტის მენეჯმენტის ფარგლებში (მაგ. ებშტეინის ანომალიისთვის ტრიკუსპიდალური სარქვლის შეკეთება) [85 -87].
შედეგი
ჩვილებისა და ბავშვების უმეტესობა, რომლებსაც აღენიშნებათ ЅVΤ, სრულად გამოჯანმრთელდება; თუმცა, რეციდივები საკმაოდ ხშირია.
●SVТ რეციდივი – პაციენტების უმეტესობას აღენიშნება ЅVТ-ის მინიმუმ ერთი განმეორებითი ეპიზოდი საწყისი ეპიზოდის შემდეგ. რეციდივის ალბათობა დამოკიდებულია პრეზენტაციის ასაკზე, ЅVT მექანიზმზე და ჩატარებულ მკურნალობაზე.
•პაციენტებისთვის, რომლებსაც ჩვილობის პერიოდში აღენიშნებათ ატრიოვენტრიკულური რეენტრ ტაქიკარდია (რომელიც არის ბავშვებში SVT-ის ყველაზე გავრცელებული მექანიზმი), სიმპტომები ხშირად ქრება ერთი წლის ასაკში, თუმცა რეციდივები შეიძლება მოგვიანებით განვითარდეს [88].
•როგორც ზემოთ იყო განხილული, პაციენტების დაახლოებით 10-15 პროცენტს, რომლებსაც ჩაუტარდათ კათეტერით აბლაცია, აღენიშნებათ გვიანი რეციდივები.
●სიკვდილობა – ЅVT-თან დაკავშირებული სიკვდილიანობის რისკი ძალიან დაბალია, თუმცა უფრო დიდია გულის სტრუქტურული დაავადების მქონე პაციენტებში (მაგ. გულის თანდაყოლილი დაავადება ან კარდიომიოპათია), ვიდრე გულის სტრუქტურული დაავადების არმქონე პაციენტებში [89,90]. პოპულაციაზე დაფუძნებულ კვლევაში ტაივანიდან, რომელიც მოიცავდა 2021 ჩვილს და ბავშვს SVT-ით საშუალოდ 10,8 წლის განმავლობაში, წლიური სიკვდილიანობის მაჩვენებელი იყო 0,2 პროცენტი წელიწადში [90]. სიკვდილიანობა ყველაზე მაღალი იყო გულის თანდაყოლილი დაავადების ან კარდიომიოპათიის მქონე პაციენტებში. მსგავსი დასკვნები დაფიქსირდა 1755 ჰოსპიტალიზებული პედიატრიული და ახალგაზრდა ზრდასრული პაციენტის რეტროსპექტულ კვლევაში (ასაკი <25 წელი) ЅVТ-ით, რომელშიც საავადმყოფოში სიკვდილიანობა იყო 6 პროცენტი გულის სტრუქტურული დაავადების მქონე პაციენტებში, 1 პროცენტი გულის სტრუქტურული დაავადების გარეშე პაციენტებში [89 ]. ვოლფ-პარკინსონ-უაიტის სინდრომის მქონე პაციენტებს აქვთ გულის უეცარი სიკვდილის რისკი, თუმცა საერთო რისკი დაბალია [91]. გულის უეცარი გაჩერება მიზეზი არის არა ЅVТ, არამედ პარკუჭის ფიბრილაცია, რომელიც შეიძლება მოხდეს წინაგულების ფიბრილაციის ეპიზოდის დროს, თუ არის პარკუჭის სწრაფი გამტარობა. ეს საკითხი უფრო დეტალურად განიხილება ცალკე.
შეჯამება და რეკომენდაციები
●მწვავე მენეჯმენტი – სუპრავენტრიკულური ტაქიკარდიის (SVТ) მწვავე მართვა ახალშობილებში და ბავშვებში მოიცავს ჩარევას, რომელიც მიმართულია ტაქიარითმიის შეწყვეტისკენ და მოიცავს პაციენტის კლინიკური სტატუსის მუდმივი შეფასებას. გადაუდებელი მკურნალობა და არჩევანი დამოკიდებულია პაციენტის ჰემოდინამიკურ სტაბილურობაზე (ცხრილი 1) (იხ. „მწვავე მართვა“ ზემოთ):
•არასტაბილური ЅVТ – სინქრონიზებული კარდიოვერიის დოზა 0,5-დან 1 ჯ/კგ-ით არის SVT-ის საბოლოო მკურნალობა ჰემოდინამიურად არასტაბილური ბავშვებში (ცხრილი 1 და ალგორითმი 1). დოზა შეიძლება გაიზარდოს 2 ჯ/კგ-მდე, თუ საწყისი დოზა არაეფექტურია. ადენოზინი შეიძლება მიეცეს კარდიოვერსიისთვის მომზადებისას, თუ პრეპარატი ხელმისაწვდომია და ბავშვს აქვს ინტრავენური (IV) წვდომა. ანალოგიურად, ვაგალური მანევრების მცდელობა შესაძლებელია შესრულდეს მედიკამენტური თერაპიისთვის მომზადებისას, მაგრამ ვაგალური მანევრების ჩატარების გამო კარდიოვერსია არ უნდა გადაიდოს. (იხილეთ „არასტაბილური პაციენტები“ ზემოთ.)
•სტაბილური SVT – პაციენტებს, რომლებიც არიან ჰემოდინამიკურად სტაბილურნი, შეიძლება მიეცეს დამატებითი დრო რიტმის შესაფასებლად. სტაბილურ პაციენტებში SVT მენეჯმენტის მიდგომა შემდეგია (ცხრილი 1) (იხ. „სტაბილური პაციენტები“ ზემოთ):
– რეკომენდებულია ვაგალურ მანევრები, როგორც საწყისი ჩარევა, ვიდრე ფარმაკოლოგიური თერაპია (1B ხარისხი). ჩვილისთვის ეს მოიცავს ყინულის ტომრის სახეზე წასმას 15-დან 30 წამამდე. უფროს ბავშვებში ვაგალური მანევრები მოიცავს დაწევას (ვალსალვას მანევრი), ერთი მხრიდან დახშულ რეზერვუარში ჩაბერვას ან თავის დაბლა პოზიციის მიღებას 15-დან 20 წამამდე. (იხილეთ „ვაგალის მანევრები“ ზემოთ.)
-თუ ვაგალური მანევრები არაეფექტურია, ჩვენ გირჩევთ IV ადენოზინს, ვიდრე სხვა ანტიარითმულ პრეპარატებს (2C ხარისხი). ადენოზინის დოზა 0.1 მგ/კგ (მაქსიმუმ 6 მგ), რასაც მოჰყვება ფიზიოლოგიური ხსნარით სწრაფი ჩარეცხვა. თუ პასუხი არ გამოვლინდა ორი წუთის განმავლობაში, დოზა უნდა გაორმაგდეს (ანუ 0.2 მგ/კგ IV, მაქსიმუმ 12 მგ). (იხილეთ „პირველი რიგის თერაპია (ადენოზინი)“ ზემოთ).
– ЅVТ-სთვის, რომელიც რეფრაქტერულია ადენოზინის მიმართ, IV ანტიარითმული თერაპიის არჩევანი მოიცავს პროკაინამიდს და ამიოდარონს. ამ პრეპარატებს აქვთ სერიოზული გვერდითი ეფექტების განვითარების პოტენციალი, ამიტომ რეკომენდებულია პედიატრიულ კარდიოლოგთან კონსულტაცია. ვერაპამილი კიდევ ერთი ვარიანტია; თუმცა, ის არ უნდა იქნეს გამოყენებული 1 წლამდე ასაკის ჩვილებში ან პაციენტებში ცნობილი ან საეჭვო ვოლფ-პარკინსონ-უაიტის (WPW) სინდრომით. ბეტა-ბლოკერებით თერაპია (მაგალითად, IV ესმოლოლი ან პერორალური პროპრანოლოლი) არის IV ანტიარითმული თერაპიის ალტერნატივა თუ SVT მსუბუქად გამოვლინდება (ანუ ჰემოდინამიკურად სტაბილური და სიმპტომების გარეშე) და პაციენტი იმყოფება მჭიდრო მონიტორინგის ქვეშ.
●შეფასება ეპიზოდის შემდეგ – მწვავე ეპიზოდის შეწყვეტის შემდეგ უნდა გაკეთდეს ელექტროკარდიოგრამა (ეკგ) და ექოკარდიოგრამა WPW სინდრომის (ტალღის ფორმა 1) და გულის სტრუქტურული დაავადების მტკიცებულების აღმოსაჩენად.
●ქრონიკული მენეჯმენტი – SVT-ის ქრონიკული მართვის ვარიანტები მოიცავს მოლოდინის მართვას, ფარმაკოლოგიურ თერაპიას და კათეტერის აბლაციას. მიდგომა მორგებულია პაციენტზე იდივიდუალურად ასაკისა და სიმპტომების სიმძიმის მიხედვით (ალგორითმი 2).
• ჩვილები <1 წელზე – ЅVТ-ის მქონე ჩვილების უმეტესობისთვის ჩვენ ვთავაზობთ პროფილაქტიკურ ფარმაკოლოგიურ თერაპიას, ვიდრე მოლოდინში მენეჯმენტს (2C ხარისხი). თუმცა მომავალი მენეჯმენტი გონივრული ვარიანტია პირველი ეპიზოდის შემდეგ, თუ ჩვილი არის ასიმპტომური და ჰემოდინამიკურად სტაბილური პარკუჭის ნორმალური ფუნქციით. პროფილაქტიკური თერაპიის გამოყენებისას ჩვენ ვთავაზობთ ბეტა ბლოკერს (მაგ. პროპრანოლოლს), როგორც პირველი რიგის აგენტს, ვიდრე სხვა პრეპარატებს (2C ხარისხი). ეს ძირითადად ეფუძნება ბეტა ბლოკატორების გვერდითი ეფექტების პროფილს, რომელიც ზოგადად უფრო ხელსაყრელია, ვიდრე სხვა ანტიარითმული პრეპარატების გვერდითი მოვლენები.
•ბავშვები ≥1 წელზე – ≥1 წლის ბავშვებისთვის ქრონიკული მართვის მიდგომა დამოკიდებულია სიმპტომების სიმძიმეზე და ბავშვის წონაზე (ალგორითმი 2)
–პირველი ეპიზოდი, მინიმალური სიმპტომები – პაციენტებისთვის, რომლებიც გამოვლენილნი არიან ЅVТ-ის პირველი ეპიზოდის შემდეგ, რომლებსაც არ აქვთ ან აქვთ მხოლოდ მინიმალური სიმპტომები და რომლებსაც არ აქვთ ჰემოდინამიკური არასტაბილურობის ან პარკუჭის დისფუნქციის ნიშნები, ჩვენ ვთავაზობთ მოლოდინ მენეჯმენტს და არა ფარმაკოლოგიურ ან კათეტერზე დაფუძნებულ ჩარევას (2C ხარისხი ). ბავშვს აკვირდებიან მინიმუმ 24 საათის განმავლობაში და მშობლებს ასწავლიან, როგორ შეამოწმონ გულისცემა. მშობლებს (და ბავშვს, თუ მას შეუძლია) ასევე ასწავლიან, თუ როგორ გამოიყენონ ვაგალური მანევრები (მაგ. ყინულის ჩანთის სახეზე წასმა, ვალსალვას მანევრის შესრულება, თავის დაბლა პოზიციის დაჭერა და სხვა ტექნიკა) თვითშეწყვეტის მიზნით SVТ-ს დროს თუ ის განმეორდება.
– მორეციდივე და/ან სიმპტომატური SVT ეპიზოდები – ბავშვებისთვის, რომლებსაც აქვთ ЅVТ-ის ხშირი ეპიზოდები ან რომლებიც სიმპტომური ხდება იშვიათი ეპიზოდების დროს, ჩვენ გირჩევთ ჩარევას შემდგომი რეციდივების თავიდან ასაცილებლად (2C ხარისხი). ინტერვენციის არჩევანი დამოკიდებულია ბავშვის წონაზე. ჩვილებისა და მცირეწლოვანი ბავშვების უმეტესობისთვის 15 კგ-ზე ნაკლები, ჩვენ ვთავაზობთ პროფილაქტიკურ სამედიცინო თერაპიას, ვიდრე კათეტერის აბლაციას (2C ხარისხი). ფარმაკოლოგიური თერაპია სასურველია ამ გარემოში, რადგან მცირეწლოვან ბავშვებში იზრდება კათეტერის აბლაციის გართულებების რისკი. ჩვენ ვთავაზობთ ბეტა-ბლოკატორს (მაგ. ატენოლოლს, ნადოლოლს), როგორც პირველი რიგის აგენტს, ვიდრე სხვა პრეპარატებს (ხარისხი 2C). ბავშვებისთვის, რომლებიც ≥15 კგ-ს იწონიან, ჩვენ ვთავაზობთ კათეტერის აბლაციას, ვიდრე ქრონიკული ანტიარითმული მედიკამენტების მიცემას (ხარისხი 2C). (იხილეთ ზემოთ „ბავშვები ≥1 წელი“ და „პირველი რიგის პროფილაქტიკური თერაპია (ბეტა ბლოკატორი)“ ზემოთ და „კათეტერის აბლაცია“ ზემოთ).
●შედეგი – ჩვილებისა და ბავშვების უმეტესობა, რომლებსაც აღენიშნებათ SVT, სრულად აღდგება ნორმალური რითმი; თუმცა ხშირია რეციდივები. ЅVΤ-თან დაკავშირებული სიკვდილიანობის რისკი ძალიან დაბალია. (იხილეთ „შედეგი“ ზემოთ.)
ცხრილი 1. სწრაფი შეფასება: SVT-ს გადაუდებელი მკურნალობა
| შეფასება |
| უზრუნველყავით ოქსიგენოთერაპია და ვენტილაცია საჭიროების მიზედვით |
| მიზანი- არასტაბილური პაციენტის დროული ამოცნობა, SVT-ს და სინუსური ტაქიკარდიის განსხვავება |
| კლინიკური შეფასება |
| სინუსური ტაქიკარდიის შესაძლო მიზეზების გამოვლენა (დეჰიდრატაცია, ცხელება, ტკივილი, მედიკამენტები) ცუდი პერფუზიის ნიშნები (გახანგრძლივებული კაპ. ავსება, ჰიპოტენზია, სიფერმკრთალე, შეცვლილი მენტალური სტატუსი) გულის უკმარისობის ნიშნები (სუნთქვაზე გაზრდილი ძალისხმევა, კრეპიტაცია, ჰეპატომეგალია) |
| ECG |
| ქვემოთ ჩამოთვლილი მოიაზრებს SVT-ს -გულისცემის სიხშირე – ჩვილებში 220-280წთ-ში. ბავშვები და მოზრდილები 180- 240 წუთში. -პათოლოგიური P კბილი (არ ფიქსირდება ან უარყოფითია II, III, aVF- განხრებში. -ფართო QRS კომპლექსის შემთხვევაში შეაფასეთ რითმის პარკუჭოვანი -წარმომავლობა. ასევე ბავშვებში,უმეტეს შემთხვევებში SVT წარმოდგენილია აბერენტული გამტარებლობით. |
| მენეჯმენტი |
| მიზანი – პათოლოგიური რითმის შეწყვეტა. ბავშვთა კარდიოლოგის კონსულტაცია | |
| სტაბილური | არასტაბილური |
| სტაბილური SVT-ის მქონე ბავშვების, რომელთა მოულოდნელად გაუარესების რისკი ძალიან დაბალი. დაიწყეთ მკურნალობა ვაგალური მანევრით და/ან ადენოზინით და მიმართეთ ბავშვთა კარდიოლოგს | არასტაბილურ პაციენტებთან (ვისთანაც გამოხატულია დათრგუნული ცნობიერება, ცუდი პერფუზია, ჰიპოტენზია ან შოკის ან მძიმე გულის უკმარისობის სხვა ნიშნები), დაუყოვნებლივ დაიწყეთ მკურნალობა, რათა დროულად გადაიყვანოთ პაციენტი სინუსურ რითმზე. საჭიროების შემთხვევაში გააგრძელეთ ჟანგბადის მიწოდება და ვენტილაცია. |
| ვაგალური მანევრები – ჩვილებს წაუსვით ყინულის ტომარა სახეზე ცხვირისა და პირის ზემოთ 15-30 წამის განმავლობაში. ნუ შეაფერხებთ ვენტილაციას. მოზრდილ ბავშვებს 15-20 წამის განმავლობაში ჩააბერინეთ დახშულ რეზერვუარში ან აწარმოეთ ვაგალური. არ გამოიყენოთ კაროტიდის მასაჟი ან ორბიტალური ზეწოლა. | ვაგალური მანევრები – არ გადადოთ მკურნალობა ვაგალური მანევრების ჩასატარებლად არასტაბილურ პაციენტებში. სცადეთ კარდიოვერსიის ან წამლის თერაპიისთვის მომზადებისას. |
| ადენოზინი – უწყვეტი ეკგ-ს მონიტორინგის პარალელურად შეყვანეთ სწრაფად IV კათეტერის მეშვეობით ცენტრალურ ცირკულაციასთან ყველაზე ახლოს. საწყისი დოზა: 0,1 მგ/კგ (მაქსიმუმ 6 მგ); თუ პასუხი არ არის 2 წუთში, გაიმეორეთ დოზა 0.2 მგ/კგ (მაქსიმუმ 12 მგ). ჩარეცხეთ თითოეული დოზა დაუყოვნებლივ 5 მლΔ ფიზიოლოგიური ხსნარით. | IV/IO წვდომა არ გვაქვს: სინქრონიზებული კარდიოვერსია – კარდიოვერსია ტარდება დაუყონებლივ ყველა არასტაბილურ პაციენტთან ვისაც IV წვდომა არ აქვს. გამოიყენეთ 0,5-დან 1 ჯ/კგ-მდე. თუ არაეფექტურია, გაზარდეთ 2 ჯ/კგ-მდე. |
| თუ გვაქვს IV/IO წვდომა ◊: ადენოზინი – თუ დაუყოვნებლივ ხელმისაწვდომია, ადენოზინი შეიძლება მიეცეს არასტაბილურ პაციენტებს ვიწრო კომპლექსური SVT-ით IV კათეტერით კარდიოვერსიის მომზადებისას. საწყისი დოზაა 0,1 მგ/კგ (მაქსიმუმ 6 მგ); თუ პასუხი არ არის 2 წუთში, გაიმეორეთ დოზა 0.2 მგ/კგ (მაქსიმუმ 12 მგ). ჩარეცხეთ თითოეულ დოზა დაუყოვნებლივ 5 მლΔ ფიზიოლოგიური ხსნარით. სინქრონული კარდიოვერსია – თუ ადენოზინი დაუყოვნებლივ არ არის ხელმისაწვდომი ან თუ არ გვაქვს პასუხი ადენოზინზე, სინქრონული კარდიოვერსია უნდა ჩატარდეს ყველა არასტაბილურ პაციენტში IV წვდომით . გამოიყენეთ 0,5-დან 1 ჯ/კგ-მდე. თუ არაეფექტურია, გაზარდეთ 2 ჯ/კგ-მდე. IV ანტიარითმული ვარიანტები რეფრაქტორული SVT-სთვის – მეორე რიგის ალტერნატიული საშუალებები, რომლებიც გამოიყენებოდა ამ მდგომარეობებში, მოიცავს IV ამიოდარონს, IV ესმოლოლს, IV პროკაინამიდს, IV სოტალოლს და IV ვერაპამილს (პაციენტებში ≥1 წლის ასაკში). მეორე რიგის აგენტის არჩევისას უნდა იხელმძღვანელოთ ექსპერტის კონსულტაციებით, პოტენციური პროარითმული და სიცოცხლისათვის საშიში ჰემოდინამიკური გვერდითი ეფექტების გათვალისწინებით, მრავალი ანტიარითმული აგენტის მიღებისას.§ | |
| SVT: სუპრავენტრიკულური ტაქიკარდია; ECG: ელექტროკარდიოგრაფია; IV: ინტრავენური; IO: ძვალშიდა; ჯ/კგ: ჯოული კილოგრამზე. * სასურველია 15-განხრიანი ეკგ. ეს მოიცავს 12 სტანდარტულ განხრას, პლუს V3R და V4R (მარცხნივ V3-ისა და V4-ის ანალოგიური მარჯვენა მხარეს) და V7 (მარცხენა უკანა აქსილარული ხაზი V4 დონეზე). თუ 15-განხრიანი ეკგ მიუწვდომელია, მისაღებია სტანდარტული 12-განხრიანი ეკგ. ეკგ მონიტორინგი უნდა გაგრძელდეს თერაპიული მანევრების დროს. Δ 2 შპრიცის გამოყენება (1 ადენოზინით და მეორე ნორმალური ფიზიოლოგიური ხსნარით) დამაგრებულია სტოპკოკზე და ის არის სასარგებლო საშუალება წამლის სწრაფი და ეფექტური მიწოდების უზრუნველსაყოფად. ◊ ადენოზინისა და ანტიარითმული პრეპარატების მიღებისას IV წვდომა უპირატესია IO-სთან შედარებით. IO შეიძლება გამოყენებულ იქნას ამ აგენტებისთვის, მაგრამ სინუსურ რიტმზე ადენოზინით გადაყვანა შეიძლება წარმატებული არ იყოს IO წვდომის გამოყენებისას. § რეკომენდებულია პედიატრიულ კარდიოლოგთან კონსულტაცია. დამატებითი დეტალებისთვის იხილეთ UpToDate-ის შინაარსი ბავშვებში ტაქიარითმიის მართვის შესახებ. | |
(ალგორითმი 1) პედიატრიული ტაქიკარდია პულსით. განახლდა 2020წელს.
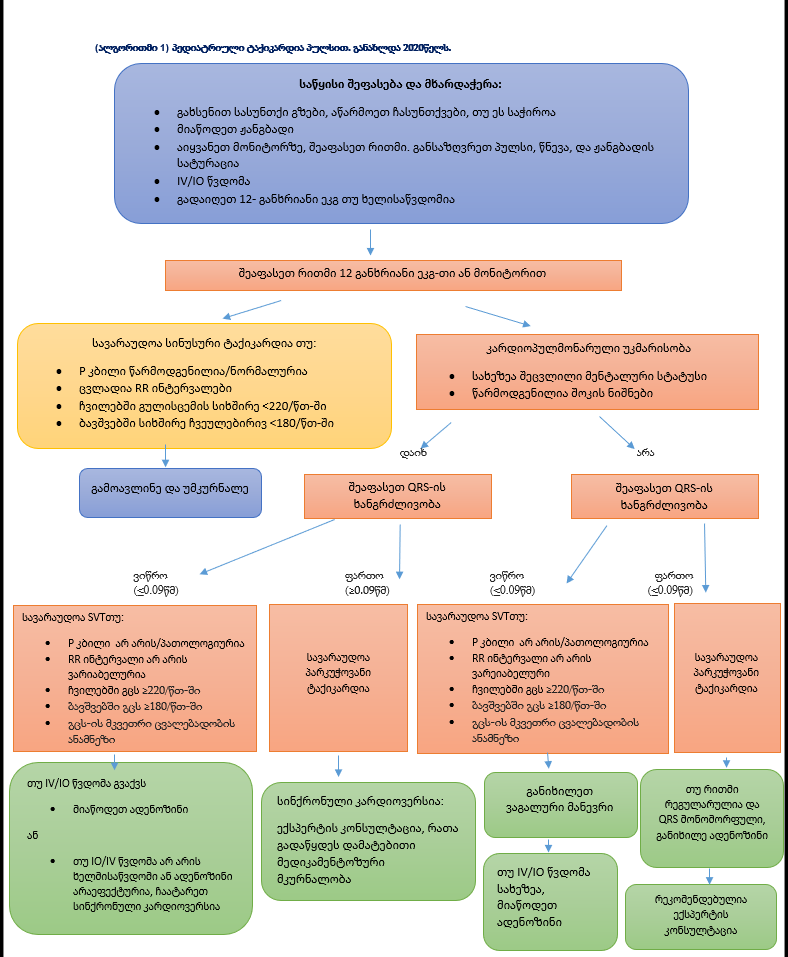
| დოზები/დეტალები |
| დაიწყე 0.5ჯ/კგ-ზე, თუ ეფექტური არ არის გაზარდე 2 ჯ/კგ-მდე. მოახდინე სედაცია თუ ამის საჭიროებაა, მაგრამ არ გადადო კარდიოვერსია |
| მედიკამენტები ადენოზინი IV/IO დოზა: პირველი დოზა: 0.1 მგ/კგ სწრაფი ბოლუსი (მაქსიმუმ: 6მგ) მეორე დოზა: 0.2 მგ/კგ) სწრაფი ბოლუსი (მაქსიმუმი მეორე დოზა: 12მგ) |
ტალღის ფორმა 2: ელექტროკარდიოგრაფიული ცვლილებები პაროქსიზმულ სუპრავენტრიკულურ ტაქიკარდიაში ადენოზინის მიღების შემდეგ
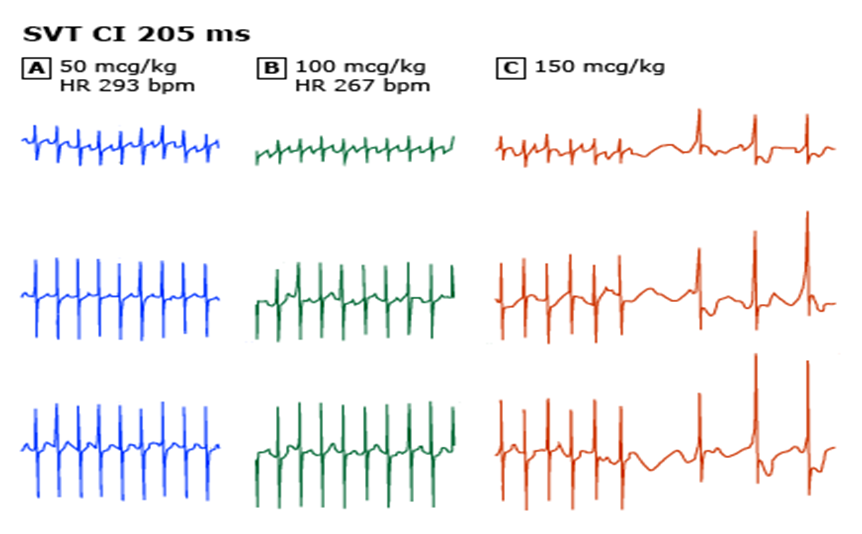
2 თვის პაციენტის ეკგ რითმების სამი კომპლექტი. პაციენტთან წარმოდგენილი იყო გულის უკმარისობის მსუბუქი ნიშნები, სიმპტომოკომპლექსს ყინულის სველი საფენი ვერ აკონვერტირებდა. გულისცემის სიხშირე იყო 293. ადენოზინის 150 მკგ/კგ დოზამ (პანელი C) წარმატებთ გადააქცია რითმი სინუსურ რითმად. უფრო ნაკლები დოზა არასაკმარისი აღმოჩნდა,ტაქსიკარდიის დროს ST-T სეგმენტებში
P ტალღები, მხარს უჭერს WPW სინდრომის არსბეობის ფაქტს. რაც ვლინდება რითმის სინუსურ რითმში კონვერტაციის შემდეგ. (პანელი C)
ტალღა 3
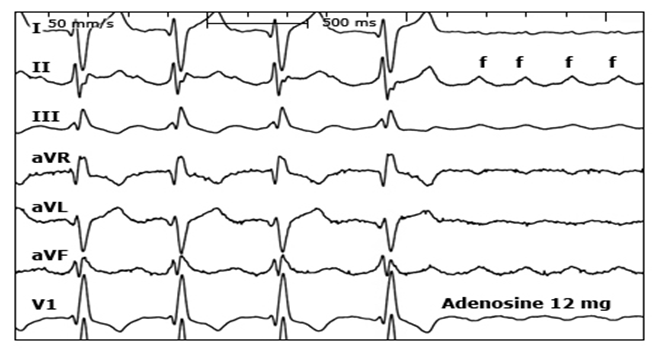
18 წლის პაციენტს ჩაუტარდა დიდი არტერიების D-ტრანსპოზიციის ოპერაცია. არსებობს 2:1 ატრიოვენტრიკულური გამტარობა და დაბალი ამპლიტუდის f ტალღები. რაც დიაგნოზის იდენტიფიცირებას ართულებს.ადენოზინის შეყვანა იწვევს f ტალღების აშკარა ვიზუალიზაციას
SVT: სუპრავენტრიკულური ტაქიკარდია; RFA: რადიოსიხშირული აბლაცია; WPW: ვოლფ-პარკინსონ-უაიტი.
¶ დიგოქსინი არ უნდა იქნეს გამოყენებული WPW სინდრომის მქონე პაციენტებში, რადგან მას შეუძლია დააჩქაროს გამტარობა დამატებით გზაზე.
Δ მოსალოდნელ მენეჯმენტში არ არის გათვალისწინებული სპეციფიური მკურნალობა. ბავშვს აკვირდებიან სულ მცირე 24 საათის განმავლობაში და მშობლებს ასწავლიან, ამოიცნონ SVT და შეწყვიტონ ეპიზოდები ვაგალური მანევრების გამოყენებით (მაგ., ყინულის პარკის სახეზე წასმა, ვალსალვას მანევრის შესრულება, თავის დაბლა პოზიციის მიღება, და აშ).
ამიოდარონის საბაზისო ტესტირება და გვერდითი ეფექტების მონიტორინგი.
| სისტემები რომელებიც ინტერესის სფეროს წარმოადგენს | მონიტორინგი | მოსალოდნელი გვერდითი ეფექტები | |
| საბაზისო კვლევა | დინამიკაში კონტროლი | ||
| კარდიული | ეკგ (საბაზისო), დოზის მიწოდების დროს | ყოველწლიურად მედიკამენტების დამატების შემდეგ, რომლებიც ურთიერთქმედებენ ამიოდარონთან ან ახანგრძლივებენ QT ინტერვალს | QT ინტერვალის გახანგრძლივება. ტორსა დე პოინტეს რითმი. |
| სინოატრიული გვანძის ან გამტარი სისტემის დარღვევები | |||
| იმპლანტირებული კარდიოვერტ-დეფიბრილატორი | დეფიბრილატორის ტესტირება | საჭიროების მიხედვით. სიმპტომები/ ნიშნების გამოვლენა | დეფიბრილაციის ბარიერის ზრდა |
| დერმატოლოგია | ფიზიკური გამოკვლევა | საჭიროების მიხედვით. სიმპტომები/ ნიშნების გამოვლენა | ულტრაიისფერი სხივების მიმართ ფოტოსენსიტიზაცია |
| კანის ლურჯი-ნაცრისფერი ფერის ცვლილება | |||
| ენდოკრინოლოგია | TSH (თუ რეფლექსის ტესტი პათოლოგიურია | 3-4 თვეში წამლის დაწყებიდან, შემდეგ ყოველწლიურად სიმპტომების და ნიშნების გამოვლენის მიხედვით | ჰიპერთირეოიდიზმი ჰიპოთირეოიდიზმი |
| ღვიძლი | AST და ALT | წამლის დაწყებიდან 6 თვეში, და შემდეგ ყოველწლიურად | AST და ALT იმატებს ორჯერ და მეტჯერ ზედა ზღვრის დასაშვებ ნორმასთან შედარებით |
| ოფთალმოლოგია | თვალების გამოკვლევა | ყოველწლიურად | რქოვანას მიკროჩანართები |
| მხედველობის ნერვის ნეიროპათია | |||
| ფილტვები | გულმკერდის რენტგენოგრაფია. PFT ფილტვის ფუნქციური ტესტი | ყოველწლიურად მეთვალყურეობა. ფილტვის ფუნქციური ტესტები (მათ შორის DLCO) და გულმკერდის კომპიუტერული ტომოგრაფია ნიშნების და სიმპტომების მიხედვით | ფილტვზე ტოქსიკური გავლენა (ხველა, ცხელება, სუნთქვის გაძნელება |
ეკგ: ელექტროკარდიოგრაფია; UV: ულტრაიისფერი; TSH: ფარისებრი ჯირკვლის მასტიმულირებელი ჰორმონი; AST: ასპარტატ ამინოტრანსფერაზა; ALT: ალანინტრანსამინაზა; PFTs: ფილტვის ფუნქციის ტესტები; DLCO: ფილტვების დიფუზური სიმძლავრე ნახშირბადის მონოქსიდისთვის.
* არსებობს განსხვავებული მოსაზრებები და არ არსებობს კონსენსუსი ფორმალური PFT-ების მიღების შესახებ დიფუზიური შესაძლებლობების (ანუ DLCO) შეფასებით, როგორც საბაზისო ტესტირება ყველა პაციენტში. ზოგიერთი ექსპერტი იღებს საწყის PFT-ებს DLCO-ით ამიოდარონის დაწყებამდე, განსაკუთრებით, ფილტვის ძირითადი დაავადების მქონე პაციენტებში, ხოლო სხვა ექსპერტები იშვიათად ან არასდროს იღებენ საწყის PFT-ებს.
REFERENCES
- Josephson ME, Wellens HJ. Differential diagnosis of supraventricular tachycardia. Cardiol Clin 1990; 8:411.
- Kleinman ME, Chameides L, Schexnayder SM, et al. Part 14: pediatric advanced life support: 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation 2010; 122:S876.
- de Caen AR, Berg MD, Chameides L, et al. Part 12: Pediatric Advanced Life Support: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation 2015; 132:S526.
- Rodriguez E, Jordan R. Contemporary trends in pediatric sedation and analgesia. Emerg Med Clin North Am 2002; 20:199.
- Guidelines for the elective use of conscious sedation, deep sedation, and general anesthesia in pediatric patients. Committee on Drugs. Section on anesthesiology. Pediatrics 1985; 76:317.
- Kugler JD, Danford DA. Management of infants, children, and adolescents with paroxysmal supraventricular tachycardia. J Pediatr 1996; 129:324.
- Roth A, Elkayam I, Shapira I, et al. Effectiveness of prehospital synchronous direct-current cardioversion for supraventricular tachyarrhythmias causing unstable hemodynamic states. Am J Cardiol 2003; 91:489.
- Lewis J, Arora G, Tudorascu DL, et al. Acute Management of Refractory and Unstable Pediatric Supraventricular Tachycardia. J Pediatr 2017; 181:177.
- Clausen H, Theophilos T, Jackno K, Babl FE. Paediatric arrhythmias in the emergency department. Emerg Med J 2012; 29:732.
- Luber S, Brady WJ, Joyce T, Perron AD. Paroxysmal supraventricular tachycardia: outcome after ED care. Am J Emerg Med 2001; 19:40.
- Bisset GS 3rd, Gaum W, Kaplan S. The ice bag: a new technique for interruption of supraventricular tachycardia. J Pediatr 1980; 97:593.
- Garson A Jr, Gillette PC, McNamara DG. Supraventricular tachycardia in children: clinical features, response to treatment, and long-term follow-up in 217 patients. J Pediatr 1981; 98:875.
- Müller G, Deal BJ, Benson DW Jr. “Vagal maneuvers” and adenosine for termination of atrioventricular reentrant tachycardia. Am J Cardiol 1994; 74:500.
- Sreeram N, Wren C. Supraventricular tachycardia in infants: response to initial treatment. Arch Dis Child 1990; 65:127.
- Campbell M, Buitrago SR. BET 2: Ice water immersion, other vagal manoeuvres or adenosine for SVT in children. Emerg Med J 2017; 34:58.
- Overholt ED, Rheuban KS, Gutgesell HP, et al. Usefulness of adenosine for arrhythmias in infants and children. Am J Cardiol 1988; 61:336.
- Paul T, Bertram H, Bökenkamp R, Hausdorf G. Supraventricular tachycardia in infants, children and adolescents: diagnosis, and pharmacological and interventional therapy. Paediatr Drugs 2000; 2:171.
- Sherwood MC, Lau KC, Sholler GF. Adenosine in the management of supraventricular tachycardia in children. J Paediatr Child Health 1998; 34:53.
- Willerson JT. July 4, 2000. Circulation 2000; 102:1.
- Crosson JE, Etheridge SP, Milstein S, et al. Therapeutic and diagnostic utility of adenosine during tachycardia evaluation in children. Am J Cardiol 1994; 74:155.
- Adenocard IV prescribing information. Astellas Pharma US, INc., February 2011. adenocard.com (Accessed on August 21, 2011).
- Strickberger SA, Man KC, Daoud EG, et al. Adenosine-induced atrial arrhythmia: a prospective analysis. Ann Intern Med 1997; 127:417.
- DeGroff CG, Silka MJ. Bronchospasm after intravenous administration of adenosine in a patient with asthma. J Pediatr 1994; 125:822.
- Bennett-Guerrero E, Young CC. Bronchospasm after intravenous adenosine administration. Anesth Analg 1994; 79:386.
- Losek JD, Endom E, Dietrich A, et al. Adenosine and pediatric supraventricular tachycardia in the emergency department: multicenter study and review. Ann Emerg Med 1999; 33:185.
- Ellenbogen KA, Thames MD, DiMarco JP, et al. Electrophysiological effects of adenosine in the transplanted human heart. Evidence of supersensitivity. Circulation 1990; 81:821.
- Flyer JN, Zuckerman WA, Richmond ME, et al. Prospective Study of Adenosine on Atrioventricular Nodal Conduction in Pediatric and Young Adult Patients After Heart Transplantation. Circulation 2017; 135:2485.
- Till J, Shinebourne EA, Rigby ML, et al. Efficacy and safety of adenosine in the treatment of supraventricular tachycardia in infants and children. Br Heart J 1989; 62:204.
- Lenk M, Celiker A, Alehan D, et al. Role of adenosine in the diagnosis and treatment of tachyarrhythmias in pediatric patients. Acta Paediatr Jpn 1997; 39:570.
- Camm AJ, Garratt CJ. Adenosine and supraventricular tachycardia. N Engl J Med 1991; 325:1621.
- Ko JK, Deal BJ, Strasburger JF, Benson DW Jr. Supraventricular tachycardia mechanisms and their age distribution in pediatric patients. Am J Cardiol 1992; 69:1028.
- Tanel RE, Walsh EP, Triedman JK, et al. Five-year experience with radiofrequency catheter ablation: implications for management of arrhythmias in pediatric and young adult patients. J Pediatr 1997; 131:878.
- Alabed S, Sabouni A, Providencia R, et al. Adenosine versus intravenous calcium channel antagonists for supraventricular tachycardia. Cochrane Database Syst Rev 2017; 10:CD005154.
- Chang PM, Silka MJ, Moromisato DY, Bar-Cohen Y. Amiodarone versus procainamide for the acute treatment of recurrent supraventricular tachycardia in pediatric patients. Circ Arrhythm Electrophysiol 2010; 3:134.
- Perry JC, Fenrich AL, Hulse JE, et al. Pediatric use of intravenous amiodarone: efficacy and safety in critically ill patients from a multicenter protocol. J Am Coll Cardiol 1996; 27:1246.
- Figa FH, Gow RM, Hamilton RM, Freedom RM. Clinical efficacy and safety of intravenous Amiodarone in infants and children. Am J Cardiol 1994; 74:573.
- Saul JP, Scott WA, Brown S, et al. Intravenous amiodarone for incessant tachyarrhythmias in children: a randomized, double-blind, antiarrhythmic drug trial. Circulation 2005; 112:3470.
- Saharan S, Balaji S. Cardiovascular collapse during amiodarone infusion in a hemodynamically compromised child with refractory supraventricular tachycardia. Ann Pediatr Cardiol 2015; 8:50.
- Desai AD, Chun S, Sung RJ. The role of intravenous amiodarone in the management of cardiac arrhythmias. Ann Intern Med 1997; 127:294.
- Soult JA, Muñoz M, Lopez JD, et al. Efficacy and safety of intravenous amiodarone for short-term treatment of paroxysmal supraventricular tachycardia in children. Pediatr Cardiol 1995; 16:16.
- Drago F, Mazza A, Guccione P, et al. Amiodarone used alone or in combination with propranolol: a very effective therapy for tachyarrhythmias in infants and children. Pediatr Cardiol 1998; 19:445.
- Epstein ML, Kiel EA, Victorica BE. Cardiac decompensation following verapamil therapy in infants with supraventricular tachycardia. Pediatrics 1985; 75:737.
- Garson A Jr. Medicolegal problems in the management of cardiac arrhythmias in children. Pediatrics 1987; 79:84.
- Stewart RB, Bardy GH, Greene HL. Wide complex tachycardia: misdiagnosis and outcome after emergent therapy. Ann Intern Med 1986; 104:766.
- Volkmann H, Dannberg G, Heinke M, Kühnert H. Termination of tachycardias by transesophageal electrical pacing. Pacing Clin Electrophysiol 1992; 15:1962.
- Barton AL, Moffett BS, Valdes SO, et al. Efficacy and safety of high-dose propranolol for the management of infant supraventricular tachyarrhythmias. J Pediatr 2015; 166:115.
- Gilljam T, Jaeggi E, Gow RM. Neonatal supraventricular tachycardia: outcomes over a 27-year period at a single institution. Acta Paediatr 2008; 97:1035.
- Seslar SP, Garrison MM, Larison C, Salerno JC. A multi-institutional analysis of inpatient treatment for supraventricular tachycardia in newborns and infants. Pediatr Cardiol 2013; 34:408.
- Sanatani S, Potts JE, Reed JH, et al. The study of antiarrhythmic medications in infancy (SAMIS): a multicenter, randomized controlled trial comparing the efficacy and safety of digoxin versus propranolol for prophylaxis of supraventricular tachycardia in infants. Circ Arrhythm Electrophysiol 2012; 5:984.
- Weindling SN, Saul JP, Walsh EP. Efficacy and risks of medical therapy for supraventricular tachycardia in neonates and infants. Am Heart J 1996; 131:66.
- Mecklin M, Linnanmäki A, Hiippala A, et al. Multicenter cohort study on duration of antiarrhythmic medication for supraventricular tachycardia in infants. Eur J Pediatr 2023; 182:1089.
- Benson DW Jr, Dunnigan A, Green TP, et al. Periodic procainamide for paroxysmal tachycardia. Circulation 1985; 72:147.
- Margolis B, DeSilva RA, Lown B. Episodic drug treatment in the management of paroxysmal arrhythmias. Am J Cardiol 1980; 45:621.
- O’Sullivan JJ, Gardiner HM, Wren C. Digoxin or flecainide for prophylaxis of supraventricular tachycardia in infants? J Am Coll Cardiol 1995; 26:991.
- Pongiglione G, Strasburger JF, Deal BJ, Benson DW Jr. Use of amiodarone for short-term and adjuvant therapy in young patients. Am J Cardiol 1991; 68:603.
- Etheridge SP, Craig JE, Compton SJ. Amiodarone is safe and highly effective therapy for supraventricular tachycardia in infants. Am Heart J 2001; 141:105.
- Fenrich AL Jr, Perry JC, Friedman RA. Flecainide and amiodarone: combined therapy for refractory tachyarrhythmias in infancy. J Am Coll Cardiol 1995; 25:1195.
- Price JF, Kertesz NJ, Snyder CS, et al. Flecainide and sotalol: a new combination therapy for refractory supraventricular tachycardia in children <1 year of age. J Am Coll Cardiol 2002; 39:517.
- Iwasawa S, Uyeda T, Saito M, et al. Efficacy and Safety of Low-Dose Amiodarone Therapy for Tachyarrhythmia in Congenital Heart Disease. Pediatr Cardiol 2018; 39:1016.
- Hill AC, Silka MJ, Bar-Cohen Y. A comparison of oral flecainide and amiodarone for the treatment of recurrent supraventricular tachycardia in children. Pacing Clin Electrophysiol 2019; 42:670.
- Sanatani S, Hamilton RM, Gross GJ. Predictors of refractory tachycardia in infants with supraventricular tachycardia. Pediatr Cardiol 2002; 23:508.
- Guerrier K, Shamszad P, Czosek RJ, et al. Variation in Antiarrhythmic Management of Infants Hospitalized with Supraventricular Tachycardia: A Multi-Institutional Analysis. Pediatr Cardiol 2016; 37:946.
- Bolin EH, Lang SM, Tang X, Collins RT. Propranolol Versus Digoxin in the Neonate for Supraventricular Tachycardia (from the Pediatric Health Information System). Am J Cardiol 2017; 119:1605.
- Knudson JD, Cannon BC, Kim JJ, Moffett BS. High-dose sotalol is safe and effective in neonates and infants with refractory supraventricular tachyarrhythmias. Pediatr Cardiol 2011; 32:896.
- Philip Saul J, Kanter RJ, WRITING COMMITTEE, et al. PACES/HRS expert consensus statement on the use of catheter ablation in children and patients with congenital heart disease: Developed in partnership with the Pediatric and Congenital Electrophysiology Society (PACES) and the Heart Rhythm Society (HRS). Endorsed by the governing bodies of PACES, HRS, the American Academy of Pediatrics (AAP), the American Heart Association (AHA), and the Association for European Pediatric and Congenital Cardiology (AEPC). Heart Rhythm 2016; 13:e251.
- An HS, Choi EY, Kwon BS, et al. Radiofrequency catheter ablation for supraventricular tachycardia: a comparison study of children aged 0-4 and 5-9 years. Pacing Clin Electrophysiol 2013; 36:1488.
- Ozaki N, Nakamura Y, Suzuki T, et al. Safety and Efficacy of Radiofrequency Catheter Ablation for Tachyarrhythmia in Children Weighing Less Than 10 kg. Pediatr Cardiol 2018; 39:384.
- Jiang HE, Li XM, Li YH, et al. Efficacy and Safety of Radiofrequency Catheter Ablation of Tachyarrhythmias in 123 Children Under 3 Years of Age. Pacing Clin Electrophysiol 2016; 39:792.
- Kugler JD, Danford DA, Deal BJ, et al. Radiofrequency catheter ablation for tachyarrhythmias in children and adolescents. The Pediatric Electrophysiology Society. N Engl J Med 1994; 330:1481.
- Kugler JD, Danford DA, Houston K, Felix G. Radiofrequency catheter ablation for paroxysmal supraventricular tachycardia in children and adolescents without structural heart disease. Pediatric EP Society, Radiofrequency Catheter Ablation Registry. Am J Cardiol 1997; 80:1438.
- Miyazaki A, Blaufox AD, Fairbrother DL, Saul JP. Cryo-ablation for septal tachycardia substrates in pediatric patients: mid-term results. J Am Coll Cardiol 2005; 45:581.
- LaPage MJ, Saul JP, Reed JH. Long-term outcomes for cryoablation of pediatric patients with atrioventricular nodal reentrant tachycardia. Am J Cardiol 2010; 105:1118.
- Drago F, Placidi S, Righi D, et al. Cryoablation of AVNRT in children and adolescents: early intervention leads to a better outcome. J Cardiovasc Electrophysiol 2014; 25:398.
- Karacan M, Çelik N, Akdeniz C, Tuzcu V. Long-term outcomes following cryoablation of atrioventricular nodal reentrant tachycardia in children. Pacing Clin Electrophysiol 2018; 41:255.
- Gallagher JJ, Svenson RH, Kasell JH, et al. Catheter technique for closed-chest ablation of the atrioventricular conduction system. N Engl J Med 1982; 306:194.
- Huang SK, Graham AR, Lee MA, et al. Comparison of catheter ablation using radiofrequency versus direct current energy: biophysical, electrophysiologic and pathologic observations. J Am Coll Cardiol 1991; 18:1091.
- Van Hare GF, Lesh MD, Scheinman M, Langberg JJ. Percutaneous radiofrequency catheter ablation for supraventricular arrhythmias in children. J Am Coll Cardiol 1991; 17:1613.
- Van Hare GF, Javitz H, Carmelli D, et al. Prospective assessment after pediatric cardiac ablation: demographics, medical profiles, and initial outcomes. J Cardiovasc Electrophysiol 2004; 15:759.
- Backhoff D, Klehs S, Müller MJ, et al. Long-Term Follow-Up After Radiofrequency Catheter Ablation of Accessory Atrioventricular Pathways in Children. JACC Clin Electrophysiol 2018; 4:448.
- Hiippala A, Happonen JM. Population-based single-center outcome for pediatric catheter ablation of common supraventricular tachycardias. Pacing Clin Electrophysiol 2015; 38:115.
- Kubuš P, Vít P, Gebauer RA, et al. Long-term results of paediatric radiofrequency catheter ablation: a population-based study. Europace 2014; 16:1808.
- Dubin AM, Jorgensen NW, Radbill AE, et al. What have we learned in the last 20 years? A comparison of a modern era pediatric and congenital catheter ablation registry to previous pediatric ablation registries. Heart Rhythm 2019; 16:57.
- Kugler JD. Radiofrequency catheter ablation for supraventricular tachycardia. Should it be used in infants and small children? Circulation 1994; 90:639.
- Backhoff D, Klehs S, Müller MJ, et al. Radiofrequency Catheter Ablation of Accessory Atrioventricular Pathways in Infants and Toddlers ≤ 15 kg. Pediatr Cardiol 2016; 37:892.
- Crawford FA Jr, Gillette PC. Surgical treatment of cardiac dysrhythmias in infants and children. Ann Thorac Surg 1994; 58:1262.
- Lazorishinets VV, Glagola MD, Stychinsky AS, et al. Surgical treatment of Wolf-Parkinson-White syndrome during plastic operations in patients with Ebstein’s anomaly. Eur J Cardiothorac Surg 2000; 18:487.
- Mavroudis C, Deal BJ, Backer CL, Tsao S. Arrhythmia surgery in patients with and without congenital heart disease. Ann Thorac Surg 2008; 86:857.
- Perry JC, Garson A Jr. Supraventricular tachycardia due to Wolff-Parkinson-White syndrome in children: early disappearance and late recurrence. J Am Coll Cardiol 1990; 16:1215.
- Salerno JC, Garrison MM, Larison C, Seslar SP. Case fatality in children with supraventricular tachycardia in the United States. Pacing Clin Electrophysiol 2011; 34:832.
- Wu MH, Chen HC, Kao FY, Huang SK. Postnatal cumulative incidence of supraventricular tachycardia in a general pediatric population: A national birth cohort database study. Heart Rhythm 2016; 13:2070.
- Cain N, Irving C, Webber S, et al. Natural history of Wolff-Parkinson-White syndrome diagnosed in childhood. Am J Cardiol 2013; 112:961.
Topic 5782 Version 45.0