ავტორი: ნანო შვანგირაძე
შესავალი
ტეტანუსი არის ნერვული სისტემის დაავდება, რომელიც ხასიათდება კუნთების სპაზმით, იგი გამოწვეულია ნიადაგში არსებული ტოქსინის წარმომქმნელი ანაერობი ბაქტერია Clostridium tetani-ით. ტეტანუსის კლინიკური მახასიათებლები და მისი კავშირი ტრავმულ დაზიანებებთან კარგად იყო ცნობილი ჯერ კიდევ ძველ ბერძნებსა და ეგვიპტელებს შორის და ასევე მრავალი ექიმი ღრმად და საფუძვლიანად იცნობდა აღნიშნულ დაავადებას 1940-იან წლებში, ეს ხდებოდა მანამ სანამ ტეტანუსის ტოქსოიდით ვაქცინაციას შემოღებდნენ. რადგან ტეტანუსის ტოქსოიდით ვაქცინაციამ მკვეთრად შეამცირა ტეტანუსის შემთხვევები მსოფლიოს მასშტაბით. ტერმინი ტრიზმი თანამედროვე ენაში არსბეობს, როგორც ტეტანუსის ერთ-ერთი მთავარი მახასიათებელი: იგი გამოხატავს კუნთების ინტენსიურ მტკივნეულ სპაზმს და პირის ღრუს გაღების შეუძლებლობას.
ტეტანუსი შეიძლება გამოვლინდეს ოთხი კლინიკური ფორმით:
1. ზოგადი
2. ადგილობრივი
3. ცეფალური
4. ნეონატალური
მიუხედავად იმისა, რომ ტეტანუსი ამჟამად იშვიათია, დაავადება კვლავ რჩება საფრთხედ ყველა არავაქცინირებული ადამიანისთვის, განსაკუთრებით შეზღუდული რესურსების მქონე ქვეყნებისთვის. ვინაიდან C. tetani სპორების აღმოიფხვრა გარემოდან შეუძლებელია, იმუნიზაცია, ჭრილობებისა და ტრავმული დაზიანებები სათანადო მკურნალობა გადამწყვეტ ფაქტორად რჩება ტეტანუსის პროფილაქტიკისთვის.
აქ განხილული იქნება ტეტანუსის ეპიდემიოლოგია, პათოგენეზი, კლინიკური მახასიათებლები, დიაგნოზი და მართვა.
ცალკე განხილულია ტეტანუსის პრევენციისა და ტეტანუსისადმი მიდრეკილი ჭრილობების მართვის პრინციპები.
ეპიდემიოლოგია
რესურსებით მდიდარი ქვეყნები
შეერთებული შტატები — რესურსებით მდიდარ ქვეყნებში ტეტანუსის ტოქსოიდით ბავშვების თითქმის უნივერსალური ვაქცინაციის გამო, ტეტანუსის სიხშირე მკვეთრად და სტაბილურად შემცირდა 1940 წლიდან მოყოლებული. 2009-2017 წლებში შეერთებული შტატების დაავადებათა კონტროლისა და პრევენციის ცენტრმა აღნიშნა, რომ დაფიქსირდა ტეტანუსის 264 შემთხვევა. 60 შემთხვევა (23 პროცენტი) იყო ≥65 წელზე უფროსი ასაკის პირებში და მხოლოდ 36 (13 პროცენტი) იყო 20 წელზე უმცროსი პირები. ტეტანუსის მქონე პაციენტების 12 პროცენტს ჰქონდა შაქრიანი დიაბეტი, ხოლო პაციენტების კიდევ 8 პროცენტი იყო ინექციური ნარკოტიკების მომხმარებელი. შემთხვევა-ფატალურობის მაჩვენებელი მთლიანობაში იყო 7.2 პროცენტი და სიკვდილის შემთხვევა დაფიქსირდა ≥55 წელზე უფროსი ასაკის პირებში. შეერთებულ შტატებში ტეტანუსის მეთვალყურეობის ეროვნული სისტემის მონაცემებით 2019 წელს დაფიქსირდა ტეტანუსის 26 შემთხვევა და 2 სიკვდილი [2]. 2009-დან 2017 წლამდე დაფიქსირდა ახალშობილთა ტეტანუსის მხოლოდ ორი შემთხვევა [1].
ტეტანუსის მქონე პაციენტების უმეტესობას არ აქვს ტეტანუსის ტოქსოიდის სრული იმუნიზაციის მიღების ისტორია და ასევე ჩატარებული აქვს არაადეკვატური პროფილაქტიკა ჭრილობის განვითარების შემდეგ [3-5]. შეერთებულ შტატებში 2001-დან 2008 წლამდე ტეტანუსის მქონე პაციენტების დაახლოებით სამი მეოთხედი, სიმპტომების დაწყებამდე მიუთითებდა გარკვეულ მწვავე დაზიანებაზე, მაგრამ ამ პირთა დაახლოებით ორი მესამედს არ მიუმართავს სამედიცინო დახმარებისთვის [3]. მწვავედ განვითარებული ჭრილობის გამო 51 პაციენტს, რომლებმაც მიმართეს კლინიკას გაეწიათ სათანადო დახმარება, მაგრამ 49 პაციენტს (96%) არ მიუღია ადეკვატური ტეტანუსის ტოქსოიდის პროფილაქტიკა ან ტეტანუსის ტოქსოიდის პროფილაქტიკა პლუს ტეტანუსის იმუნოგლობულინი [3]. თუმცა, ზოგიერთ პაციენტს ადრე არსებული ანტიტეტანუსის ანტისხეულების არსებობის მიუხედავად (როგორც გაზომილია ზღვის გოჭთან ან თაგვთან) მაინც განუვითარდათ ტეტანუსი [6].
შეერთებულ შტატებში კლინიკური დაავადების განვითარების დაბალი მაჩვენებლის მიუხედავად, ბევრი ზრდასრული ტეტანუსის წინააღმდეგ არაადეკვატურად არის აცრილი.
2015-2016 წლების ჯანმრთელობისა და კვების ეროვნული კვლევის (NHANES) მონაწილეებთან გაზომეს ანტიტეტანუსის ტოქსოიდის ანტისხეულების კონცენტრაცია და ტეტანუსის საწინააღმდეგო ანტისხეულების დამცველობითი დონე გამოვლინდა (>0.1 საერთაშორისო ერთეული/მლ) მოსახლეობის 93.8 პროცენტში იმ პაციენტებში რომელთა ასაკი ≥69 წელზე, მაგრამ შემცირდა 69 წელზე მეტი ასაკის წარმომადგენლებთან [7].
გასაკვირი არ არის, რომ დამცველობითი ანტისხეულების დონეები უფრო სავარაუდოა მოზრდილებში, რომლებსაც აქვთ სამხედრო სამსახურის ისტორია, უმაღლესი განათლება და მაღალი შემოსავალი [8].
რესურსებით მდიდარი სხვა ქვეყნები – ტეტანუსის წლიური სიხშირე რესურსებით მდიდარ ქვეყნებშიც დაბალია და მათი სიხშირის შემცირება უკავშირდება ვაქცინაციის პროგრამებს. 2021 წელს ინგლისსა და უელსში გამოვლინდა ტეტანუსის 11 შემთხვევა, მათგან ექვსი შემთხვევა დაფიქსირდა ბავშვებში, რაც განვითარდა რუტინული ვაქცინაციის მიღებამდე [9]. 2001-დან 2014 წლამდე საავადმყოფოს ჩანაწერების შესწავლამ დაადგინა, რომ ინგლისში შემთხვევების დაახლოებით 88 პროცენტი არ არის შეტყობინებული [10].
ევროპის ქვეყნებს შორის შემთხვევების ყველაზე მეტი რაოდენობა იტალიაში დააფიქსირდა, მაგრამ წლიური სიხშირე შემცირდა 0,5-დან 0,01-მდე 100000-ზე 1970-2021 წლებში [11]. 2021 წელს დაფიქსირებული 50 ევროპული შემთხვევის საერთო სიკვდილიანობა გამოვლინდა 20 პროცენტ შემთხვევაში.
რესურსებით შეზღუდული ქვეყნები – განსხვავებით რესურსებით მდიდარი ქვეყნებისგან, სადაც ტეტანუსი იშვიათია, ტეტანუსი რჩება ენდემურ დაავადებად რესურსებით შეზღუდული გარემოში [12,13] და სიხშირე ხშირად იზრდება ისეთი ბუნებრივი კატასტროფების შემდეგ, როგორიცაა მიწისძვრები და ცუნამი [14]. დაავადების ჭეშმარიტი სიხშირე უცნობია, რადგან ტეტანუსი არც ისე კარგად ცნობილი დაავადებაა უმეტეს ქვეყნებში.
2014 წელს უგანდაში ნაციონალური ჰოსპიტალის მიმღების მონაცემებმა გამოავლინა ტეტანუსის სულ 4750 შემთხვევა (125 შემთხვევა მილიონ მოსახლეზე) [15]. ამ შემთხვევების უმეტესობა დაფიქსირდა 5 წელზე უფროსი ასაკის პირებში.
შემთხვევების სიკვდილიანობის მაჩვენებელი ბევრ რესურსით შეზღუდულ გარემოში რჩება მაღალი და მნიშვნელოვნად არ შეცვლილა ბოლო რამდენიმე ათწლეულის განმავლობაში. დაავადების გლობალური ტვირთის კვლევის მონაცემების მიხედვით, 2016 წელს მსოფლიოში ტეტანუსის შედეგად დაიღუპა 48,000-დან 80,000-მდე ადამიანი [16]. 27 კვლევაში მოხსენებული 3043 ზრდასრული აფრიკელი პაციენტის ფატალურობის მაჩვენებელი იყო 43 პროცენტი (95% CI 37-დან 50 პროცენტამდე) [17]. სიკვდილიანობის მაღალი მაჩვენებელი, სავარაუდოდ, ასახავს იმ ფაქტს, რომ ბევრ სამედიცინო დაწესებულებაში მექანიკური ვენტილაცია ხშირად მიუწვდმელია.
1995 წლისათვის ჯანდაცვის მსოფლიო ორგანიზაციამ მიზნად ისახავდა ახალშობილთა ტეტანუსის აღმოფხვრა, 2015 წელს დაახლოებით 34 000 ადამიანი დაიღუპა აღნიშნული მდგომარეობით [18]. მიუხედავად იმისა, რომ სიკვდილიანობის შემთხვევები 96 პროცენტით შემცირდა 1988 წელთან შედარებით [18], 2023 წლის დეკემბრისთვის 11 ქვეყანას ჯერ კიდევ არ ჰქონდა აღმოფხვრილი დედათა და ახალშობილთა ტეტანუსი [18].
COVID-19-ის პანდემიის დროს ეროვნული პროგრამების შეფერხების შემდეგ, ჯანმო-მ განაცხადა, რომ ახალშობილთა ტეტანუსის შემთხვევების რაოდენობა გაიზარდა პრიორიტეტულ ქვეყნებში 18 (31 პროცენტი) 2020-დან 2022 წლამდე, რაც ხაზს უსვამს მდგრადი პრევენციის პროგრამების საჭიროებას [19]. (იხილეთ „ახალშობილთა ტეტანუსი“ ქვემოთ.)
პათოგენეზი
ტეტანუსი ჩნდება მაშინ, როდესაც C. tetani-ს სპორები, ობლიგატური ანაერობი, რომელიც ჩვეულებრივ იმყოფება ძუძუმწოვრების ნაწლავებში და ფართოდ გვხვდება ნიადაგში, იძენს წვდომას ადამიანის დაზიანებულ ქსოვილზე. ინოკულაციის შემდეგ, C. tetani გარდაიქმნება ვეგეტატიურ ღეროს ფორმის ბაქტერიად და წარმოქმნის მეტალოპროტეაზას ტეტანუსის ტოქსინს (ასევე ცნობილია როგორც ტეტანოსპაზმი).
მოტორულ ნეირონში რეტროგრადული აქსონალური ტრანსპორტით ზურგის ტვინსა და ტვინის ღეროში მიღწევის შემდეგ, ტეტანუსის ტოქსინი გამოიყოფა და შედის მიმდებარე ინჰიბიტორულ ინტერნეირონებში, სადაც ის ბლოკავს ნეიროტრანსმისიას მემბრანის ცილებზე, რომლებიც მონაწილეობენ ნეიროეგზოციტოზში [20-24]. ტოქსინის ეფექტი არის ინჰიბიტორული ნეიროტრანსმისიის ინაქტივაცია, რომელიც ჩვეულებრივ არეგულირებს წინა რქის უჯრედებს და კუნთების შეკუმშვას. წინა რქის უჯრედების და ავტონომიური ნეირონების დათრგუნვის (ანუ დეზინჰიბირების) დაკარგვა იწვევს კუნთების ტონუსის გაზრდას, მტკივნეულ სპაზმებს და ფართო ავტონომიურ არასტაბილურობას.
ტეტანუსის დროს კუნთების რიგიდობის განვითარება ხდება რთული მექანიზმით, რომელიც გულისხმობს დეზინჰიბირებული მოტორული ნეირონების გადაცემის სიჩქარის ზრდას და აფერენტულ სენსორულ სტიმულებზე რეფლექსური მოტორული რეაქციების დათრგუნვის ნაკლებობას [25]. ტეტანუსის ტოქსინით გამოწვეული კატექოლამინების თირკმელზედა ჯირკვლის მიერ გამოყოფის ნერვული კონტროლის ნაკლებობა იწვევს ჰიპერსიმპატიკურ მდგომარეობას, რომელიც ვლინდება ოფლიანობით, ტაქიკარდიით და ჰიპერტენზიით.
წინა რქების უჯრედებზე, თავის ტვინის ღეროსა და ავტონომიურ ნეირონებზე ტეტანუსის ტოქსინით გამოწვეული ზემოქმედება ხანგრძლივია, რადგან გამოჯანმრთელება მოითხოვს ახალი აქსონალური ნერვული ტერმინალის ზრდას.
ნერვულ უჯრედებთან შეკავშირების და დათრგუნვის მექანიზმები დაკავშირებულია ტეტანუსის ტოქსინის მოლეკულის სპეციფიკურ ნაწილებთან. ტეტანუსის ტოქსინი თავდაპირველად წარმოიქმნება არააქტიური პოლიპეპტიდური ჯაჭვის სახით, რომელიც აქტიურად მზარდია ორგანიზმში. ამ სინთეზს აკონტროლებს უჯრედშიდა პლაზმიდში მდებარე გენები.
ტოქსინის გამოიყოფის შემდეგ, ის აქტიურდება ბაქტერიული ან ქსოვილის პროტეაზებით მის აქტიურ ფორმაში გადასვლით, რომელიც შეიცავს მძიმე ჯაჭვს, რაც აუცილებელია ნეირონებში შესვლისთვის და მის ტოქსიკურ თვისებებზე პასუხისმგებელ მსუბუქ ჯაჭვს [23,25-27]. მძიმე ჯაჭვები შემდგომში პეპსინებით იშლება კონკრეტულ ფრაგმენტებად, რომლებიც ინდივიდუალურად განაპირობებენ შეკავშირებას ნერვულ უჯრედებთან. ნეიროტრანსმიტერების განთავისუფლების პრესინაფსური დათრგუნვა ხდება მსუბუქი ჯაჭვების საშუალებით.
ტეტანოლიზინი არის კიდევ ერთი ტოქსინი, რომელსაც გამოიმუშავებს C. tetani მისი ადრეული ზრდის ფაზაში. მას აქვს ჰემოლიზური თვისებები და იწვევს მემბრანის დაზიანებას სხვა უჯრედებშიც, მაგრამ მისი როლი კლინიკურ ტეტანუსში გაურკვეველია.
წინასწარგანწყობის ფაქტორები – იმის გამო, რომ C. tetani არ იზრდება ჯანსაღ ქსოვილებში, უნდა იყოს ფაქტორების კონვერგენცია, რათა ტეტანუსის ტოქსინმა შესაბამის განვითარება ჰპოვოს ადამიანის ორგანიზმში. ფაქტორების ეს კომბინაცია ჩვეულებრივ მოიცავს ანტისხეულების არარსებობას (რაც ძირითადად არაადეკვატური ვაქცინაციის შედეგია) პლუს უნდა არსებობდეს ორი ან მეტი ქვემოთ ჩამოთვლილი ფაქტორი:
●შეღწევადი დაზიანება, რომელიც იწვევს C. tetani სპორების ინოკულაციას
●კოინფექცია სხვა ბაქტერიებთან
●დევიტალირებული ქსოვილი
●უცხო სხეული
●ლოკალიზებული იშემია
ზემოაღნიშნული ფაქტორები ხსნის, თუ რატომ არის ტეტანუსისადმი მიდრეკილი დაზიანებები, ისეთი დაზიანებები როგორიცაა ნამსხვრევები და სხვა პუნქციური ჭრილობები, ცეცხლსასროლი იარაღის ჭრილობები, რთული მოტეხილობები, დამწვრობა და არასტერილური ინტრამუსკულური ან კანქვეშა ინექციები (რაც ხშირად ხდება ინექციური ნარკოტიკების მომხმარებლებში).
ამ მიდრეკილ ფაქტორებს ასევე შეუძლიათ ახსნან, თუ რატომ შეიძლება განვითარდეს ტეტანუსი ისეთ უჩვეულო კლინიკურ პირობებში, როგორიცაა:
● ახალშობილები (ჭიპის ყუნწის ინფექციის გამო)
●სამეანო პაციენტები (სეპტიური აბორტების შემდეგ)
● ოპერაციის შემდგომი პაციენტები (ნეკროზული ინფექციით, რომელიც მოიცავს ნაწლავის ფლორას)
●მოზარდები და მოზრდილები, რომლებსაც უტარდებათ მამაკაცის წინადაცვეთა სუბსაჰარის აფრიკაში [28]
●სტომატოლოგიური ინფექციების მქონე პაციენტები
●დიაბეტური პაციენტები კიდურები ინფიცირებული წყლულით
●პაციენტები, რომლებიც იღებენ კუსტარულ და/ან დაბინძურებულ ნარკოტიკებს [29]
ტეტანუსი იდენტიფიცირებადი მიზეზის გარეშე – ტეტანუსის იდენტიფიცირებადი წინამორბედი მიზეზი აშკარაა ტეტანუსის მქონე პაციენტების უმეტესობაში, მაგრამ ტეტანუსის კლასიკური ნიშნებისა და სიმპტომების მქონე პაციენტების მეოთხედში არ არის გამოვლენილი მიზეზი. სავარაუდოდ, უმნიშვნელო შეუმჩნეველი აბრაზიები ან კანის დაზიანებები პასუხისმგებელია ამ „კრიპტოგენურ“ შემთხვევის უმეტესობაზე ან ყველაზე. ტეტანუსი იშვიათად აღენიშნებოდა პაციენტებს, რომლებმაც მიიღეს ტეტანუსის იმუნიზაციის დროული და სწორი სერია [30].
კლინიკური მახასიათებლები
ინკუბაციური პერიოდი – ტეტანუსის ინკუბაციური პერიოდი დაახლოებით 8 დღეა, მაგრამ მერყეობს 3-დან 21 დღემდე [31]. ინკუბაციური პერიოდი ჩვეულებრივ უფრო მოკლეა ახალშობილთა ტეტანუსის დროს, ვიდრე სხვა შემთხვევებში [27].
გენერალიზებული ტეტანუსი — ტეტანუსის ყველაზე გავრცელებული და მძიმე კლინიკური ფორმა არის გენერალიზებული ტეტანუსი. ასეთი პაციენტთა 80 პროცენტზე მეტის გამომჟღავნებელი სიმპტომია ტრიზმი, თუმცა გენერალიზებული ტეტანუსის მქონე პაციენტებს ზოგჯერ თავდაპირველად აღენიშნებათ ცეფალური ან ლოკალიზებული ტეტანუსი. ზოგადი ტეტანუსის მქონე პაციენტებს ჩვეულებრივ აღენიშნებათ ავტონომიური ჭარბი აქტივობის სიმპტომები, რომლებიც შეიძლება გამოვლინდეს ადრეულ ფაზებში, როგორც ოფლიანობა და ტაქიკარდია. ავადმყოფობის შემდგომ ფაზებში ხშირად გვხვდება უხვი ოფლიანობა, გულის რითმის დარღვევები, ლაბილური ჰიპერტენზია ან ჰიპოტენზია და ცხელება.
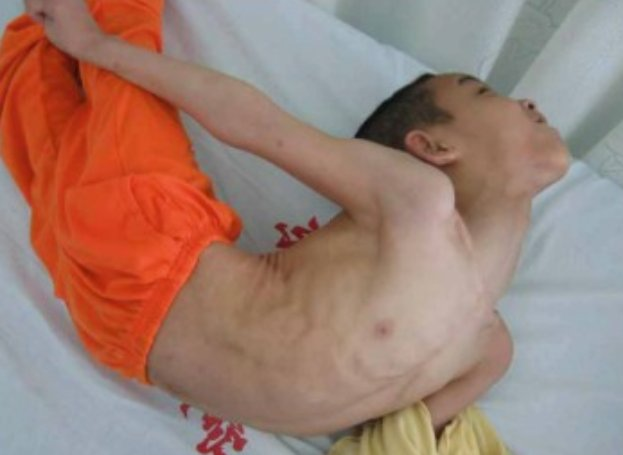
სისტემური ტეტანუსის მქონე პაციენტებს ახასიათებთ ჩონჩხის კუნთების მატონიზირებელი შეკუმშვა და წყვეტილი ინტენსიური კუნთების სპაზმები. ვინაიდან ტეტანუსის მქონე პაციენტებს არ აქვთ ცნობიერების დაქვეითება, მატონიზირებელი შეკუმშვაც და სპაზმიც მეტისმეტად მტკივნეულია. ტეტანური სპაზმი შეიძლება გამოწვეული იყოს ძლიერი ხმებით ან სხვა სენსორული სტიმულებით, როგორიცაა მაგალითად ფიზიკური კონტაქტი ან სინათლე. მატონიზირებელი და პერიოდული სპასტიური კუნთების შეკუმშვა პასუხისმგებელია ტეტანუსის კლასიკური კლინიკური გამოხატულებების უმეტესობაზე, როგორიცაა:
●კისრის დაჭიმულობა
●ოპისტოტონუსი
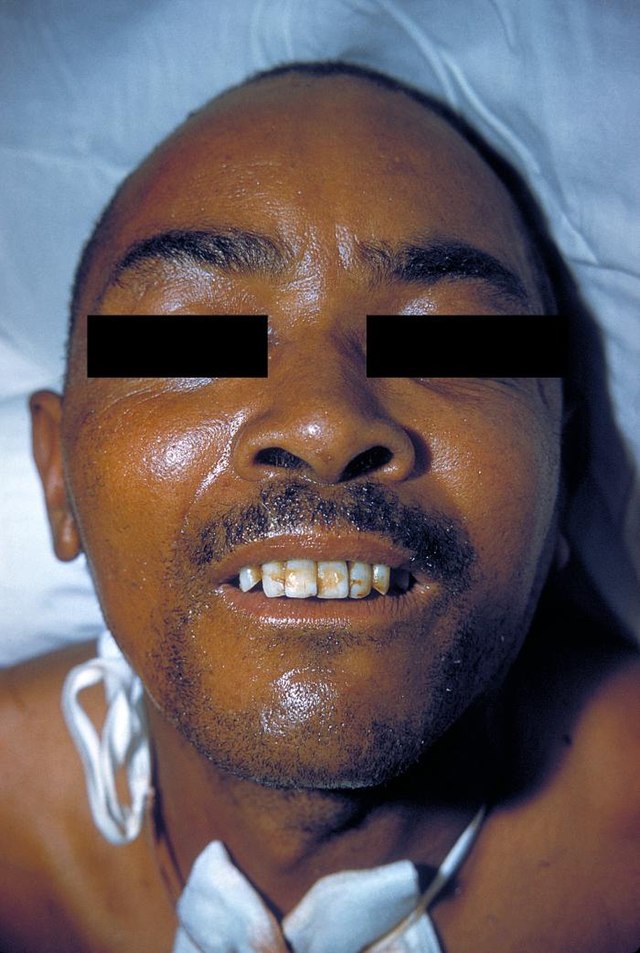
●Risus sardonicus (სარდონული ღიმილი)
●დაფის მსგავსი ხისტი, დაჭიმული მუცელი
● აპნოეს და/ან ზედა სასუნთქი გზების ობსტრუქციის პერიოდები გულმკერდის კუნთების და/ან გლოტალური ან ფარინგეალური კუნთების შეკუმშვის გამო.
●დისფაგია
გენერალიზებული ტეტანური სპაზმების დროს, პაციენტი ხშირად კრავს მუშტს, და აკეთებენ არკას ზურგით, გამოხატულია მხრების და ფეხების აბდუქცია, ხშირად ამ დრამატული პოზებს დროს პაციენტს აღენიშნება აპნოე.
სარდონიკული ღიმილი
ოპისტოტონუსი
ადგილობრივი ტეტანუსი – იშვიათად, ტეტანუსი ვლინდება კუნთების მატონიზირებელი და სპასტიური შეკუმშვით ერთ კიდურში ან სხეულის ერთ რეგიონში. ადგილობრივი ტეტანუსი ხშირად, მაგრამ არა ყოველთვის, გადაიზრდება გენერალიზებულ ტეტანუსში. ლოკალური ტეტანუსის დიაგნოზი შეიძლება იყოს რთულად დასასმელი. მაგალითად, იშვიათად ადრეული ტეტანუსის მქონე პაციენტებს შეიძლება განუვითარდეთ დეფანსი, რომელიც ფრიად ემსგავსება მწვავე ქირურგიულ მუცელს.
ცეფალური ტეტანუსი – თავის ან კისრის დაზიანებების მქონე პაციენტებს შეიძლება აღენიშნებოდეთ ცეფალიური ტეტანუსი, რომელიც მოიცავს თავდაპირველად მხოლოდ კრანიალურ ნერვებს. ადგილობრივი ტეტანუსის სხვა ფორმების მსგავსად, ცეფალიური ტეტანუსის მქონე პაციენტებს ხშირად შემდგომში უვითარდებათ გენერალიზებული ტეტანუსი. გენერალიზებული ტეტანუსის ტიპიური ნიშნების გამოვლენამდე, ცეფალიური ტეტანუსის მქონე პაციენტებმა შეიძლება გამოავლინონ დამაბნეველი კლინიკური გამოვლინებები, მათ შორის დისფაგია, ტრიზმი და კრანიალური ნეიროპათია, რამაც შეიძლება გამოიწვიოს ინსულტის არასწორი დიაგნოზი [32].
სახის ნერვის ჩართულობა ყველაზე ხშირად გვხვდება ცეფალიური ტეტანუსის შემთხვევაში [33], მაგრამ კრანიალური ნერვების VI, III, IV და XII ჩართვა ასევე შეიძლება მოხდეს ინდივიდუალურად ან სხვა ნერვებთან ერთად.
ახალშობილთა ტეტანუსი – ახალშობილთა ტეტანუსი წარმოიქმნება ცუდად იმუნიზირებული დედების შთამომავლებში ასეპტიკური ტექნიკის გამოუყენებლობის შედეგად ჭიპი მართვის დროს. არატრადიციული ნივთიერებების გამოყენება ჭიპზე (მაგ. ნაღები ან გამწმენდი კარაქი, სხვადასვხა წვენები და ძროხის ფეკალიები, რომელიც ზოგიერთ ქვეყანაში ახალშობილთა ჭიპის მართვის ტრადიციული მეთოდია) ჩართული იყო როგორც საერთო კულტურული პრაქტიკა, რომელიც ხელს უწყობს ახალშობილთა ტეტანუსის განვითარებას [34]. ახალშობილთა ტეტანუსი ასევე შეიძლება გამოწვეული იყოს დაბინძურებული ხელებითა და ხელსაწყოებით ან მშობიარობის ველში ჭუჭყის არსებობით, ჩალით ან სხვა არასტერილური მასალებით დაბინძურებით.
ახალშობილთა ტეტანუსი ჩვეულებრივ გვხვდება ახალშობილებში დაბადებიდან 5-7 დღის შემდეგ (3-დან 24 დღემდე) [27]. დაავადების დაწყება ჩვეულებრივ უფრო სწრაფია ახალშობილთა ტეტანუსში, ვიდრე ხანდაზმულებში და შეიძლება პროგრესირებდეს საათების განმავლობაში და არა დღეების განმავლობაში, ალბათ იმიტომ, რომ აქსონის სიგრძე ჩვილებში პროპორციულად უფრო მოკლეა [35].
ახალშობილთა ტეტანუსი ვლინდება კვებაზე უარის თქმით და პირის ღრუს გაღების გაძნელებით ტრიზმის განვითარების გამო, იმ ახალშობილში, რომელსაც ადრე შეეძლო ნორმალურად კვება და ტირილი [27]. შემდეგ წოვა ჩერდება და სახის კუნთების სპაზმი ხდება, რამაც შეიძლება გამოიწვიოს risus sardonicus (სარდონული ღიმილი). ხელები ხშირად მოჭიმულია, ტერფები იკეცება და კუნთების ტონუსი იზრდება. დაავადების პროგრესირებასთან ერთად ახალშობილები ხდებიან ხისტი და ვითარდება ოპისტოტონუსი (ზურგის ექსტენსორების სპაზმი).
დაავადების სიმძიმე – ტეტანუსის კლინიკური ნიშნების სიმძიმე და სიხშირე შეიძლება განსხვავდებოდეს სხვადასხვა კონკრეტულ შემთხვევაში, იგი დამოკიდებულია ტეტანუსის ტოქსინის რაოდენობაზე, რომელიც აღწევს ცენტრალურ ნერვულ სისტემაში. სიმპტომები და ნიშნები შეიძლება პროგრესირებდეს დაავადების დაწყებიდან ორი კვირის განმავლობაში. სიმძიმე უკავშირდება დაავადების ინკუბაციურ პერიოდს და ინტერვალს სიმპტომების დაწყებიდან სპაზმების გაჩენამდე [36]; რაც უფრო გრძელია ინტერვალი, მით უფრო მსუბუქია ტეტანუსის კლინიკური ნიშნები. უფრო მძიმე დაავადება ვლინდება ღრმად შეღწევადობის მქონე ჭრილობების არსებობის შემთხვევაში [36].
ავადმყოფობის ხანგრძლივობა – ტეტანუსის ტოქსინით გამოწვეული ეფექტები ხანგრძლივია, რადგან ითვლება, რომ აღდგენა მოითხოვს ახალი აქსონური ნერვული ტერმინალის ზრდას. კლინიკური ტეტანუსის ჩვეულებრივი ხანგრძლივობა ოთხიდან ექვს კვირამდეა.
დიაგნოსტიკა
ტეტანუსის დიაგნოზი ჩვეულებრივ აშკარაა და ზოგადად შეიძლება დაისვას ზემოთ ჩამოთვლილი ტიპიური კლინიკური შედეგების საფუძველზე. ტეტანუსზე განსაკუთრებით უნდა ვიეჭვოთ, თუ არსებობს წინა ტეტანუსისადმი მიდრეკილი დაზიანება და ტეტანუსის არაადეკვატური იმუნიზაციის ისტორია. თუმცა, ტეტანუსი ზოგჯერ შეიძლება შეგვეშალოს სხვა პროცესებში. ეს საკითხი განხილულია შემდეგ ნაწილში.
დიფერენციალური დიაგნოზი
ტეტანუსი ზოგჯერ შეიძლება მიემსგავსოს სხვა დაავადებებს.
მედიკამენტებით გამოწვეული დისტონიები, როგორიცაა ფენოთიაზინებით გამოწვეული დისტონია – წამლისმიერი დისტონია ხშირად იწვევს თვალების მკვეთრ გადახრას, თავისა და კისრის მკვეთრ მოძრაობებს და სპაზმებს შორის მატონიზირებელი კუნთების შეკუმშვის არარსებობას. ამის საპირისპიროდ, ტეტანუსი არ იწვევს თვალის გადახრებს და კუნთებისთვის დამახასიათებელია მატონიზირებელი შეკუმშვა სპაზმებს შორის. დაბოლოს, ანტიქოლინერგული აგენტის მიღება, როგორიცაა ბენზტროპინის მეზილატი, ჩვეულებრივ, დაუყოვნებლივ აღმოფხვრის სპაზმებს, რომლებიც ვლინდება წამლით გამოწვეული დისტონიის დროს. ასეთი თერაპია არ ახდენს გავლენას ტეტანუსის მქონე პაციენტებზე.
ტრიზმი სტომატოლოგიური ინფექციის გამო – სტომატოლოგიურმა ინფექციებმა შეიძლება გამოიწვიოს ტრიზმი, რომელიც იშვიათ შემთხვეევბში შეიძლება მიემსგავსოს ტეტანუსის ცეფალურ ფორმებს. თუმცა, აშკარა სტომატოლოგიური აბსცესის არსებობა და პროგრესირების არარსებობა ან ზედმიწევნითი სპაზმები ჩვეულებრივ ავლენს განსხვავებას ორ დაავადებას შორის პირველადი შეფასების და/ან დაკვირვების პერიოდის შემდეგ.
სტრიქნინით მოწამვლა ვირთხის შხამის მიღების გამო – სტრიქნინით შემთხვევით ან განზრახ მოწამვლამ შეიძლება გამოიწვიოს ტეტანუსის მსგავსი კლინიკური სინდრომი. ორივე მდგომარეობის დამხმარე ზრუნვა კრიტიკულია; ამრიგად, ორივე მდგომარეობის საწყისი მკურნალობა იდენტურია. სისხლის, შარდისა და ქსოვილის ანალიზი სტრიქნინზე შეიძლება ჩატარდეს სპეციალურ საცნობარო ლაბორატორიებში. ასეთი ტესტები უნდა ჩატარდეს, როდესაც არსებობს რაიმე ეჭვი შემთხვევითი ან განზრახ მოწამვლის შესახებ, ან როდესაც არ არსებობს ტეტანუსის წინა დაზიანების ან ინფექციის ტიპიური ისტორია ან პაციენტი ადეკვატურად არის იმუნიზირებული ტეტანუსის საწინააღმდეგოდ.
ავთვისებიანი ნეიროლეფსიური სინდრომი – ავთვისებიანი ნეიროლეფსიური სინდრომის მქონე პაციენტებს შეიძლება აღენიშნებოდეთ ავტონომიური არასტაბილურობა და კუნთების რიგიდობა. თუმცა, ცხელების არსებობა, შეცვლილი ფსიქიკური მდგომარეობა და ამ გართულების გამომწვევი აგენტის ბოლოდროინდელი მიღება, ჩვეულებრივ, ტეტანუსისგან განსხვავებას შედარებით მარტივს ხდის.
ხისტი პიროვნების სინდრომი — ხისტი პიროვნების სინდრომი (SPS) არის იშვიათი ნევროლოგიური აშლილობა, რომელიც ხასიათდება კუნთების ძლიერი დაჭიმულობით. ტორსისა და კიდურების სპაზმი შეიძლება განვითარდეს ნებაყოფლობითი მოძრაობებით ან სმენითი, ტაქტილური ან ემოციური სტიმულაციის შედეგად, ეს ყველაფერი ასევე შეიძლება მოხდეს ტეტანუსის დროს. ტრიზმის ან სახის სპაზმის არარსებობა და დიაზეპამზე სწრაფი რეაგირება განასხვავებს SPS-ს ნამდვილი ტეტანური სპაზმებისგან [37]. გარდა ამისა, SPS ასოცირდება გლუტამინმჟავას დეკარბოქსილაზას წინააღმდეგ აუტოანტისხეულებთან. (იხ. “Stiff-Person Syndrome”).
მკურნალობა
მიმოხილვა – ტეტანუსის მკურნალობა უნდა ჩატარდეს ინტენსიური თერაპიის განყოფილებაში ანესთეზიოლოგთან ან კრიტიკული თერაპიის სპეციალისტთან კონსულტაციის შემდეგ, რომელიც გაწვრთნილია ამ დაავადების გართულებების მართვაში, მათ შორის, ფლობს სასუნთქი გზების ადრეულ და აგრესიული მართვის მეთოდებს.
მკურნალობის მიზნები მოიცავს:
1. ტოქსინების გამომუშავების შეჩერება
2. შეუკავშირებელი ტოქსინის ნეიტრალიზაცია
3. სასუნთქი გზების მართვა
4. კუნთების სპაზმების კონტროლი
5. დისავტონომიის მართვა
6. ზოგადი დამხმარე მენეჯმენტი
სამწუხაროდ, მცირე მტკიცებულება არსებობს ტეტანუსის რაიმე კონკრეტული თერაპიული ჩარევის მხარდასაჭერად. ბოლო 20 წლის განმავლობაში ლიტერატურაში მხოლოდ ექვსი რანდომიზირებული კვლევაა მოხსენებული [38].
ტოქსინების წარმოების შეჩერება
ჭრილობის მართვა – ტეტანუსის მქონე ყველა პაციენტმა უნდა გაიაროს ჭრილობის დებრიდინგი სპორებისა და ნეკროზული ქსოვილის აღმოსაფხვრელად, რამაც შეიძლება შექმნას განვითარების იდეალური პირობები.
ანტიმიკრობული თერაპია – მიუხედავად იმისა, რომ ანტიბიოტიკები, სავარაუდოდ, შედარებით უმნიშვნელო როლს თამაშობენ ტეტანუსის მართვაში, ისინი საყოველთაოდ რეკომენდებულია. თუმცა, მნიშვნელოვანია ხაზგასმით აღვნიშნოთ, რომ შესაბამისმა ანტიმიკრობულმა თერაპიამ შეიძლება ვერ აღმოფხვრას C. tetani, თუ არ განხორციელდება ჭრილობის ადექვატური დებრიდინგი. ეს ილუსტრირებული იყო ერთ-ერთმა კვლევაში, რომელშიც C. tetani-ს 45 იზოლაცია იქნა მიღებული ჭრილობის ინფიცირების დროს 84 ვიეტნამელი პაციენტისგან რომელთაც აღენიშნებოდათ მძიმე ტეტანუსი [39]. 45-ვე იზოლატი მგრძნობიარე იყო დისკის დიფუზიით და E-ტესტით პენიცილინისა და მეტრონიდაზოლის მიმართ და ყველა იყო რეზისტენტული ტრიმეტოპრიმ-სულფამეთოქსაზოლის მიმართ. თუმცა, C. tetani იზოლირებული იყო ორი პაციენტის ჭრილობებისგან, რომლებმაც გაიარეს დებრიდინგი პენიცილინის მაღალი დოზების ორ კვირაზე მეტი ხნის შემდეგ.
მეტრონიდაზოლი (500 მგ ინტრავენურად [IV] ყოველ ექვს-რვა საათში) არის რეკომენდებული მკურნალობა ტეტანუსის დროს, მაგრამ პენიცილინი G (2-დან 4 მილიონ ერთეულ IV ყოველ ოთხ-ექვს საათში) უსაფრთხო და ეფექტური ალტერნატივაა [14]. რეკომედნებულია მკურნალობა გაგრძელდეს 7-დან 10 დღემდე.
პირვლემა კვლევამ, რომელიც ახდენდა პენიცილინისა და მეტრონიდაზოლის შედარებას, გამოავლინდა სიკვდილიანობის უფრო დიდი ოდენობით შემცირება მეტრონიდაზოლის ჯგუფში (7% VS 24 %) [40]. თუმცა, სამ მომდევნო კვლევაში არ გამოვლინდა სიკვდილიანობაში განსხვავება იმ პაციენტებში, რომლებიც მკურნალობდნენ პენიცილინით და მათთან შედარებით, ვინც მკურნალობდა მეტრონიდაზოლით [41-43]. ერთ-ერთ კვლევაში, პაციენტები, რომლებიც იღებდნენ მეტრონიდაზოლს, სჭირდებოდათ ნაკლები მიორელაქსანტები და სედატიური საშუალებები [41]. შესაძლებელია, რომ დაკვირვების შედეგად გამოვლინილი განსხვავება შედეგებში არ იყოს განპირობებული ორი აგენტის ანტიმიკრობული აქტივობის განსხვავებებით, არამედ იგი აიხსნება პენიცილინისა და მესამე თაობის ცეფალოსპორინების GABA ანტაგონისტური ეფექტით, რასაც შუძლია გამოიწვიოს ცენტრალური ნერვული სისტემის (ცნს) აგზნებადობა.
შერეული ინფექციის ეჭვის შემთხვევაში, შეიძლება გამოყენებულ იქნას პირველი, მეორე ან მესამე თაობის ცეფალოსპორინი, როგორიცაა ცეფაზოლინი (1-დან 2 გ IV ყოველ 8 საათში), ცეფუროქსიმი (2 გ IV ყოველ 6 საათში) ან ცეფტრიაქსონი (1-დან 2 გ ინტრავენურად ყოველ 24 საათში).
ალტერნატიული საშუალებაა დოქსიციკლინი (100 მგ ყოველ 12 საათში); C. tetani-ს წინააღმდეგ აქტივობის სხვა აგენტებია მაკროლიდები, კლინდამიცინი, ვანკომიცინი და ქლორამფენიკოლი [14,44]. ამ აგენტების ეფექტურობა არ არის შეფასებული, მაგრამ, ინ ვიტრო მგრძნობელობის მონაცემებზე დაყრდნობით, სავარაუდოა, რომ ისინი ეფექტურია.
შეუკავშირებელი ტოქსინის ნეიტრალიზაცია – ვინაიდან ტეტანუსის ტოქსინი შეუქცევადად არის შეკავშირებული ქსოვილებთან, ნეიტრალიზაციისთვის ხელმისაწვდომია მხოლოდ შეუკავშირებელი ტოქსინი. პასიური იმუნიზაციის (ანუ ანტიტოქსინის) გამოყენება შეუკავშირებელი ტოქსინის გასანეიტრალებლად ასოცირდება გადარჩენის გაუმჯობესებასთან და ის ითვლება გადარჩენის სტანდარტად [45].
●ინტრამუსკულარული ანტიტოქსინი – ადამიანის ტეტანუსის იმუნოგლობულინი (HTIG) არის არჩევითი ანტიტოქსინი შეუკავშირებელი ტოქსინის გასანეიტრალებლად. შეერთებული შტატების დაავადებათა კონტროლისა და პრევენციის ცენტრი (CDC) რეკომენდაციას უწევს ერთჯერად დოზას 500 ერთეული ინტრამუსკულარულად (IM) [46,47]. ადრე რეკომენდებული დოზის დიაპაზონი იყო 3000-დან 6000 ერთეულამდე.
HTIG უნდა დაინიშნოს ტეტანუსის დიაგნოზის განხილვისთანავე, დოზის ნაწილი ინფილტრირებული ჭრილობის გარშემო [46,47]. HTIG ტეტანუსის ტოქსიოიდისაგან განსხვავებით უნდა დაინიშნოს სხვადასხვა ადგილას. (იხილეთ „აქტიური იმუნიზაცია“ ქვემოთ.)
თუ HTIG არ არის ხელმისაწვდომი, ადამიანის იმუნოგლობულინი ან ცხენის ანტიტოქსინი გონივრული ალტერნატივაა. ვიეტნამში ჩატარებულ ბრმა, რანდომიზებულ კვლევაში განხილულ იქნა 215 ტეტანუსის მქონე ზრდასრული, რომელის დროსაც მოხდა ცხენის ანტიტოქსინის (21,000 საერთაშორისო ერთეული) შედარება HTIG-თან (3000 საერთაშორისო ერთეული), შედარების საფუძველზე არ გამოვლენილა განსხვავება მექანიკური ვენტილაციის საჭიროების სიხშირეში, ასევვე საავადმყოფო/ინტენსიური თერაპიის განყოფილებაში (ICU) დაყოვნების ხანგრძლივობაში, სიკვდილიანობაში [48] ან გვერდითი მოვლენებში.
ცხენის ანტიტოქსინის გამოყენებისას, 0,1 მლ ინტრადერმული ტესტის დოზა 1:10 განზავებით უნდა იქნას შეყვანილი სრული დოზის მიცემამდე, რათა შეფასდეს ჰიპერმგრძნობელობის რეაქციები [14]. ამის საპირისპიროდ, ადამიანის პრეპარატის გამოიყენებისას წინამორბედი კანის სინჯი არ არის საჭირო.
●ინტრათეკალური ანტიტოქსინის როლი – ზოგადად, ინტრათეკალური ანტიტოქსინის როლი დაუდგენელია. მაგალითად, ვიეტნამიდან ზემოთ აღწერილი 215 პაციენტის კვლევაში, მექანიკური ვენტილაციის მაჩვენებელი მათ შორის, ვინც იღებდა ინტრათეკალურ ანტიტოქსინს ინტრამუსკულური ანტიტოქსინთან ერთად, მსგავსი იყო მათთან შედარებით ვინც იღებდა მხოლოდ IM ანტიტოქსინს (43 წინააღმდეგ 50 პროცენტი, შესაბამისად; ფარდობითი რისკი 0.87, 95% CI 0.66-დან 1.1.1-მდე). სხვა კვლევაში, რომელიც ჩატარდა ბრაზილიაში მონაწილეობდა 120 პაციენტი, სადაც აფასებდნენ ინტრათეკალური იმუნოგლობულინის გამოყენებას ინტრამუსკულარული თერაპიასთან ერთად, კლვევით გამოვლინდა რომ პაციენტები, რომლებიც იტარებდნე ინტრათეკალურ თერაპიას, ჰქონდათ სპაზმების ხანმოკლე ხანგრძლივობა, უფრო ხანმოკლე საავადმყოფოში დაყოვნების დრო და რესპირატორული დახმარების ნაკლები საჭიროება; თუმცა, სიკვდილიანობაზე მნიშვნელოვნი გავლენა არ მოუხდენია. [49].
აქტიური იმუნიზაცია – ვინაიდან ტეტანუსი არის იმ მცირერიცხოვან ბაქტერიულ დაავადებათაგანი, რომელიც არ ტოვებს იმუნიტეტს მწვავე დაავადების გამოჯანმრთელების შემდეგ, ტეტანუსის მქონე ყველა პაციენტმა უნდა მიიღოს აქტიური იმუნიზაცია ტეტანუსის და დიფტერიის ტოქსოიდის შემცველი ვაქცინების სრული სერიით (მაგ.სამი დოზით მოზრდილებში და 7 წელზე მეტი ასაკის ბავშვებში), დიაგნოზის დაწყებისთანავე. ასეთი ვაქცინები უნდა ჩატარდეს ტეტანუსის იმუნოგლობულინისგან განსხვავებულ ადგილას. კონკრეტული რეკომენდაციები ვაქცინის ფორმულირებებისა და ვაქცინაციის გრაფიკის შესახებ დეტალურად განიხილება ცალკე.
ტეტანუსის შემდგომი დოზები, ტეტანუსის და დიფტერიის ტოქსოიდის ან ტეტანუსის, დიფტერიის, ყივანახველას სახით, ზრდასრულებში რეკომენდებულია 10-წლიანი ინტერვალით ბევრ ქვეყანაში, მათ შორის შეერთებულ შტატებში [50]. მხოლოდ ტეტანუსის ტოქსოიდი უნდა მიეცეს მხოლოდ იმ პაციენტებს, რომლებსაც აქვთ დოკუმენტირებული ალერგია ან დიფტერიის ტოქსოიდზე არასასურველი რეაქციები.
კუნთების სპაზმების კონტროლი – კუნთების გენერალიზებული სპაზმები სიცოცხლისთვის საშიშია, რადგან მათ შეუძლიათ გამოიწვიონ სუნთქვის უკმარისობა, ასპირაცია და გენერალიზებული გამოფიტვა. ამ სპაზმების გასაკონტროლებლად შეიძლება გამოყენებულ იქნას რამდენიმე პრეპარატი. წარსულში, წამლების ხელმისაწვდომობამდე, პაციენტის მოსათავსებელი გარემო იყო მთავარი მკურნალობის მნიშვნელოვანი კომპონენტი, კერძოდ ოთახში სინათლის ან ხმაურის კონტროლი კუნთების სპაზმის პროვოცირების თავიდან აცილების მიზნით მნიშვნელოვან სამკურნალო დეტალს წარმოადგენდა. ეს ზომები ჯერ კიდევ სასიცოცხლოდ მნიშვნელოვანია რეგიონებში, სადაც ნეირომუსკულური ბლოკირების აგენტების ხელმისაწვდომობა შეიძლება შეზღუდული იყოს [14].
ბენზოდიაზეპინები და სხვა სედატიური საშუალებები
●ბენზოდიაზეპინები – ბენზოდიაზეპინები მკურნალობის ტრადიციული მეთოდია და ზოგადად ეფექტურია ტეტანუსთან დაკავშირებული რიგიდობისა და სპაზმების გასაკონტროლებლად [14]. ისინი ასევე უზრუნველყოფენ დამამშვიდებელ ეფექტს. დიაზეპამი გამოიყენებოდა ყველაზე ხშირად, მაგრამ სხვა ბენზოდიაზეპინები ისეთივე ეფექტურია, როგორც დიაზეპამი.
ტეტანუსის დროს დიაზეპამის ჩვეულებრივი საწყისი დოზა ზრდასრულთათვის არის 10-30 მგ ინტრავენურად და მეორდება საჭიროებისამებრ ყოველ 1-დან 4 საათში ერთხელ. ტეტანუსის მქონე პაციენტები ხშირად ავლენენ ტოლერანტობას ბენზოდიაზეპინების დამამშვიდებელი ეფექტების მიმართ და პაციენტი შეიძლება დარჩეს ფხიზლად და ცნობიერად, დოზების მიღების შემდეგ, რომლებიც აწყნარებს ან იწვევს ანესთეზიას სხვა პაციენტებში [30].
ვინაიდან ბენზოდიაზეპინები შეიძლება საჭირო გახდეს ხანგრძლივი პერიოდის განმავლობაში (ხშირად კვირით), ისინი თანდათან უნდა შემცირდეს, რათა თავიდან იქნას აცილებული მოხსნის რეაქციები და ვენტილაციის დარღვევა.
თვისებები, ჩვეულებრივი დოზირების რეჟიმი სედაციისთვის და ბენზოდიაზეპინების არასასურველი ეფექტები უფრო დეტალურად განიხილება ცალკე.
●სხვა სედატიური საშუალებები – საანესთეზიო პროპოფოლის ინფუზიამ შეიძლება ასევე გააკონტროლოს სპაზმი და რიგიდობა. მისი ხანგრძლივი გამოყენება დაკავშირებულია ლაქტოაციდოზთან, ჰიპერტრიგლიცერიდემიასთან და პანკრეასის დისფუნქციასთან.
ნეირომუსკულური მაბლოკირებელი აგენტები – ნეირომუსკულური მაბლოკირებელი საშუალებები გამოიყენება მაშინ, როდესაც მარტო სედაცია არაადეკვატურია. არჩევანი დამოკიდებულია ხელმისაწვდომობაზე. მოწოდებულია ვეკურონიუმი ან სხვა გულ-სისხლძარღვთა ინერტული ნეირომუსკულური ბლოკატორები. პანკურონიუმი, ხანგრძლივი მოქმედების აგენტი, ტრადიციულად გამოიყენებადი მედიკამენტია, მაგრამ მან შეიძლება გააუარესოს ავტონომიური არასტაბილურობა, რადგან ის წარმოადგენს კატექოლამინების უკუმიტაცების ინჰიბიტორს. ნეირომუსკულური მაბლოკირებელი აგენტები ჩვეულებრივ ინიშნება უწყვეტი ინფუზიის სახით. ამ პრეპარატებზე პაციენტების მონიტორინგი ძალზე მნიშვნელოვანია გართულებების თავიდან აცილების ან დროული ამოცნობისთვის.
ბაკლოფენი, რომელიც ასტიმულირებს პოსტსინაფსურ GABA ბეტა რეცეპტორებს, გამოიყენეს რამდენიმე მცირე კვლევაში. რეკომენდებული მიწოდების გზა არის ინტრათეკალური გზა და ის შეიძლება მიეცეს ბოლუსის სახით, 1000 მკგ ან უწყვეტი ინტრათეკალური ინფუზიის სახით [51]. პორტუგალიაში, ერთერთ სამედიცინო ცენტრში ჩატარდა რეტროსპექტული კლვევა, სადაც გამოვლინდა, რომ ინტრათეკალური ბაკლოფენი, რომელიც მიცემული იყო საწყისი ბოლუსის სახით, დოზით 40-დან 200 მკგ-მდე, რასაც შემდგომ მოჰყვა უწყვეტი ინფუზია 20 მკგ/საათში, აღმოჩნდა, რომ ეფექტურად აკონტროლებდა სპაზმს და რიგიდობას III ხარისხის ტეტანუსის მქონე 22 პაციენტიდან 21-ში. 22 პაციენტიდან ერთს განუვითარდა მენინგიტი ინტრათეკალური კათეტერის ინფექციის შედეგად, მიუხედავად იმისა, რომ პაციენტების უმეტესობას ესაჭიროებოდა ასეთი თერაპია მინიმუმ სამი კვირის განმავლობაში (დიაპაზონი 8-დან 30 დღემდე) [52]. ზოგიერთ შემთხვევაში, ბაკლოფენი გამოიყენება მექანიკური ვენტილაციის საჭიროებასთან არ იყო ასოცირებული [53]. ფენოთიაზინები და ბარბიტურატები წარსულში გამოიყენებოდა სპაზმების გასაკონტროლებლად, მაგრამ ისინი მეტწილად ჩანაცვლდნენ ნეირომუსკულური ბლოკირების აგენტებით.
ავტონომიური დისფუნქციის მართვა – რამდენიმე პრეპარატი იქნა გამოყენებული ადრენერგული ბლოკადის წარმოებისთვის და ავტონომიური ჰიპერაქტიურობის ჩასახშობად; ტეტანუსის რანდომიზებულ კლინიკურ კვლევაში მხოლოდ მაგნიუმის სულფატით მკურნალობა იყო შესწავლილი [54].
მაგნიუმის სულფატი – მაგნიუმის სულფატი მოქმედებს როგორც პრესინაფსური ნეირომუსკულური ბლოკატორი, ბლოკავს კატექოლამინების გამოყოფას ნერვებიდან და ამცირებს რეცეპტორების რეაქციას კატექოლამინების მიმართ [55]. ტეტანუსის მქონე პაციენტებში, რამდენიმე კლინიკურმა სერიამ აღწერა მაგნიუმის გამოყენება ავტონომიური დისფუნქციის მართვისთვის და როგორც დამხმარე მკურნალობა სპაზმების კონტროლისთვის [54,56-59].
ვიეტნამში ჩატარებულ რანდომიზებულ, ორმაგ ბრმა კვლევაში მონაწილეობდა მძიმე ტეტანუსით დაავდებული 256 ჰოსპიტალიზირებულ პაციენტი, კვლევაში მოხდა მაგნიუმის სულფატის ინფუზიის შედარება პლაცეობოსთან [54]. პაციენტებს შემთხვევითი რეჟიმით მინიჭებული ჰქონდათ მაგნიუმის სულფატი (დამტვირთავი დოზა 40 მგ/კგ 30 წუთის განმავლობაში, რასაც მოჰყვა უწყვეტი ინფუზია ან 2 გ საათში 45 კგ-ზე მეტი წონის პაციენტებისთვის ან 1.5 გ საათში ≤45 კგ პაციენტებისთვის) პლაცებოს (5 პროცენტი გლუკოზა წყალში) ინფუზიასთან შედარებით. მაგნიუმის ინფუზიამ მნიშვნელოვნად შეამცირა სხვა მედიკამენტების საჭიროება კუნთების სპაზმის გასაკონტროლებლად და პაციენტები, რომლებიც მკურნალობდნენ მაგნიუმით, 4,7-ჯერ (95% CI 1,4-დან 15,9-მდე) ნაკლებად მოითხოვდნენ ვერაპამილს გულ-სისხლძარღვთა არასტაბილურობის სამკურნალოდ, ვიდრე პლაცებოს ჯგუფში მყოფი პაციენტები. მაგნიუმის სულფატის ინფუზიამ არ შეამცირა მექანიკური ვენტილაციის საჭიროება.
მაგნიუმს ასევე შეიძლება ჰქონდეს დადებითი გავლენა კუნთების სპაზმის შემცირებისთვის. ორ მცირე არაბრმა კვლევაში, მაგნიუმის სულფატის ინფუზიამ შეამცირა სპაზმი დიაზეპამთან შედარებით [60,61].
ბეტა ბლოკერები – ლაბეტალოლი (0,25-დან 1 მგ/წთ) ხშირად იყო გამოყენებული, რადგან მას გააჩნია ორმაგი მოქმედება, კერძოდ, ალფა- და ბეტა-მაბლოკირებელი ეფექტები. მაგალითად, პროპრანოლოლთან ერთად ბეტა ბლოკერების გამოყენება თავიდან უნდა იქნას აცილებული რადგან აღწერილია უეცარი სიკვდილის შემთხვევები [62]. მორფინის სულფატი (0,5-დან 1 მგ/კგ საათში უწყვეტი ინტრავენური ინფუზიით) ჩვეულებრივ გამოიყენება ავტონომიური დისფუნქციის გასაკონტროლებლად და სედაციის გამოსაწვევად.
სხვა პრეპარატები – სხვა სამკურნალო საშუალებები სხვადასხვა ავტონომიური მოვლენების სამკურნალოდ, რომლებიც შესაძლებელია იყოს ეფექტური, არის დექსმედეტომიდინი, ატროპინი, კლონიდინი და ეპიდურული ბუპივაკაინი.
სასუნთქი გზების მართვა და სხვა დამხმარე ზომები – ვინაიდან ტეტანუსის ტოქსინი ვერ გამონთავისუფლდება ნერვული სისტემიდან ნეირონებთან შეერთების შემდეგ, დამხმარე მკურნალობა ტეტანუსის მთავარი მკურნალობაა. მძიმე ტეტანუსის მქონე პაციენტებში ხშირია ინტენსიური თერაპიის განყოფილებაში ხანგრძლივად იმყოფებიან უმოძრაო მდგომარეობაში, რომლთა დიდი ნაწილიც მექანიკურ ვენტილაციაზეა, რაც შეიძლება გაგრძელდეს კვირების განმავლობაში. ასეთ პაციენტებს აქვთ მიდრეკილება ნოზოკომიური ინფექციების, ნაწოლების, წყლულების, ტრაქეის სტენოზის, კუჭ-ნაწლავის სისხლდენისა და თრომბოემბოლიური დაავადების განვითარებიკენ.
ენდოტრაქეალური ინტუბაცია საწყის ეტაპზე გამართლებულია, მაგრამ ადრეული ტრაქეოსტომია ხშირად ნაჩვენებია გახანგრძლივებული მექანიკური ვენტილაციის ალბათობის გამო. ეს უკანასკნელი საშუალებას იძლევა მოხდეს ტრაქეის უკეთესი სანაცია და ფილტვის ტუალეტი.
ტეტანუსის დროს ენერგიის მოთხოვნილება შეიძლება იყოს ძალიან მაღალი, ამიტომ ადრეული ნუტრიციული მხარდაჭერა სავალდებულოა. სასურველია ენტერალური კვება. პროფილაქტიკური მკურნალობა სუკრალფატით ან მჟავას ბლოკატორებით შეიძლება გამოყენებულ იქნას სტრესური წყლულების გამო გასტროეზოფაგური სისხლდენის თავიდან ასაცილებლად.
ადრეულ ეტაპზე უნდა ჩატარდეს თრომბოემბოლიის პროფილაქტიკა ჰეპარინით, დაბალი მოლეკულური წონის ჰეპარინით ან სხვა ანტიკოაგულანტებით.
ფიზიკური თერაპია უნდა დაიწყოს სპაზმების შეწყვეტისთანავე, რადგან ტეტანუსის მქონე პაციენტებს ხშირად რჩებიან ინვალიდები კუნთების გახანგრძლივებული დაქვეითებისა და კონტრაქტურების გამო [63].
განხილვები რესურსებით შეზღუდულ გარემოში – კრიტიკული მოვლის სერვისები ხშირად მიუწვდომელია ან ელემენტარულია რესურსებით შეზღუდული ბევრ ქვეყანაში [14]. იქ სადაც კრიტიკული მედიცინის განყოფილება არ არის ხელმისაწვდომი,სიკვდილის მთავარ მიზეზს წარმოადგენს მწვავე რესპირატორული უკმარისობა. ICU–ს არარსებობის შემთხვევაში, იდეალურ შემთხვავაში გამოყოფილ უნდა იქნეს ცალკე პალატა ან ოთახი ტეტანუსის მქონე პაციენტებისთვის, რათა სენსორული სტიმულები მინიმუმამდე იქნეს დაყვანილი, რადგან ძლიერმა ხმებმა, ფიზიკურმა კონტაქტმა და სინათლემ შეიძლება გამოიწვიოს ტეტანური სპაზმის პროვოცირება [14]. დაცვის სხვა ვარიანტებში შედის თვალის დაჩრდილვა და ყურის საცობები სტიმულის შესამცირებლად. არადეპოლარიზებული პარალიზური საშუალებები, როგორიცაა ვეკურონიუმი და პანკურონიუმი, არ არის უსაფრთხო ვენტილაციური მხარდაჭერის არარსებობის შემთხვევაში. თუმცა, ასეთ სიტუაციებში, შესაძლებელია ბენზოდიაზეპინების და ბაკლოფენის გამოყენება თუკი დოზები საგულდაგულოდ არის ტიტრირებული სუნთქვის დათრგუნვის თავიდან ასაცილებლად. მაგნიუმის სულფატი შეიძლება გამოყენებულ იქნას ავტონომიური დისფუნქციის სამართავად და კუნთების სპაზმის დამხმარე საშუალებად. (იხილეთ „კუნთების სპაზმის კონტროლი“ ზემოთ და „მაგნიუმის სულფატი“ ზემოთ).
პროფილაქტიკა
პუნქციური ჭრილობის შემდეგ ტეტანუსის პროფილაქტიკა დეტალურად განიხილება ცალკე. შემდეგი ცხრილი აჯამებს ტეტანუსის პროფილაქტიკის მიდგომას (ცხრილი 1).
ჭრილობის მენეჯმენტი და ტეტანუსის პროფილაქტიკა
| ტეტანუსის ტოქსიოიდის წინა დოზა* | სუფთა ან მცირე ჭრილობა | ყველა სხვა ჭრილობა¶ | ||
| ტეტანუსის ტოქსიოდის შემცველი ვაქცინაΔ | ადამიანის ტეტანუსის იმუნოგლობულინი | ტეტანუსის ტოქსიოიდის შემცველი ვაქცინაΔ | ადამიანის ტეტანუსის იმუნოგლობულინი◊ | |
| <3 დოზა ან უცნობია. | დიახ§ | არა | დიახ§ | დიახ |
| ≥3 დოზა | მხოლოდ, თუ ბოლო დოზა მიცემულ იქნა ≥10 წლის წინ | არა | მხოლოდ თუ ბოლო დოზა მიცემულ იქნა ≥5 წლის წინ¥ | არა |
ტეტანუსის შესაბამისი პროფილაქტიკა უნდა ჩატარდეს ჭრილობის განვითარებიდან რაც შეიძლება მალე, მაგრამ უნდა ჩაუტარდეს იმ პაციენტებსაც კი, რომლებიც გვიან მიმართავენ სამედიცინო დახმარებას. ეს იმიტომ ხდება, რომ ინკუბაციური პერიოდი საკმაოდ ცვალებადია; შემთხვევების უმეტესობა ხდება 8 დღის განმავლობაში, მაგრამ ინკუბაციური პერიოდი შეიძლება იყოს 3 დღე ან 21 დღემდე. პაციენტებისთვის, რომლებსაც ადრე ჰქონდათ ჩატარებული ტეტანუსის საწინააღმდეგო ვაქცინაცია, მაგრამ არ არიან რევაქცინირებულნი, სავარაუდოდ მცირე სარგებელი ექნება ადამიანის ტეტანუსის იმუნოგლობულინის შეყვანას ტრავმიდან 1 კვირაზე მეტი ხნის შემდეგ. თუმცა, პაციენტებს, რომლებიც ფიქრობენ, რომ სრულიად არავაქცინირებულები არიან, ადამიანის ტეტანუსის იმუნოგლობულინი უნდა მიეცეს ტრავმვის განვითარებიდან 21 დღემდე ვადაში; ასეთ პაციენტებს ერთდროულად უნდა ჩაუტარდეს Td ან Tdap ვაქცინაცია.
DT: ადსორბირებული დიფტერია-ტეტანუსის ტოქსოიდები; DTP/DTwP: დიფტერია-ტეტანუსი ცელელარული ყივანახველა; DTaP: დიფტერია-ტეტანუსის აცელულარული ყივანახველა; Td: აბსორბირებადი ტეტანუს-დიფტერიას ტოქსიოდი; Tdap:ბუსტერი ტეტანუსის ტოქსოიდით- შემცირებული დიფტერიის ტოქსოიდი-ცელულარული ყივანახველა; TT: ტეტანუსის ტოქსიოიდი.
* ტეტანუსის ტოქსოიდი შესაძლოა შეყვანილ იქნას როგორც DT, DTP/DTwP (აღარ არის ხელმისაწვდომი აშშ-ში), DTaP, Td, Tdap ან TT (აღარ არის ხელმისაწვდომი აშშ-ში).
¶ როგორიცაა, ჭრილობები რომელიც დაბინძურებულია, ჭუჭყით, განავლით, ნიადაგით ან ნერწყვით დაბინძურებული ჭრილობები; ნაჩხვლეტი ჭრილობები; ავულსიები; ან ტრავმული, დამწვრობის ან მოყინვის შედეგად მიღებული ჭრილობები.
Δ რეკომენდებული ვაქცინის მომზადება დამოკიდებულია პაციენტის ასაკზე და ვაქცინაციის ისტორიაზე:
- <7 წელზე: DTaP.
- არაიმუნური ბავშვები ≥7 და <11 წლამდე, რომლებსაც ადრე არ მიუღიათ Tdap: Tdap. ბავშვებს, რომლებიც იღებენ Tdap-ს 7-დან 9 წლამდე, უნდა მიიღონ Tdap-ის კიდევ ერთი დოზა 11-დან 12 წლამდე.
- ≥11 წელი: Tdap-ის ერთჯერადი დოზას უპირატესობა ენიჭება ამ ასაკობრივი ჯგუფის ყველა ინდივიდისთვის, რომლებსაც ადრე არ მიუღიათ Tdap; წინააღმდეგ შემთხვევაში, Td ან Tdap შეიძლება დაინიშნოს უპირატესობის გარეშე. ორსულმა ქალებმა უნდა მიიღონ Tdap ყოველი ორსულობის დროს.
◊ 250 ერთეული ინტრამუსკულარულად განსხვავებულ ადგილას, ვიდრე ტეტანუსის ტოქსოიდი იქნა გაკეთებული; იმუნოგლობულინის ინტრავენური შეყვანა უნდა მოხდეს, თუ ადამიანის ტეტანუსის იმუნოგლობულინი არ არის ხელმისაწვდომი. აივ ინფექციით ან მძიმე იმუნოდეფიციტის მქონე პირებმა, რომლებსაც აქვთ დაბინძურებული ჭრილობები, ასევე უნდა მიიღონ ადამიანის ტეტანუსის იმუნოგლობულინი, მიუხედავად ტეტანუსის იმუნიზაციის ისტორიისა.
§ ვაქცინების სერია უნდა გაგრძელდეს დასრულებამდე საჭიროებისამებრ.
¥ 5 წელიწადში ერთხელ მიცემული გამაძლიერებელი დოზები არ არის საჭირო და შეიძლება გაზარდოს გვერდითი მოვლენები.
ორსული ან მშობიარობის ასაკის ქალების იმუნიზაცია ამცირებს ახალშობილთა ტეტანუსის სიკვდილიანობას დაახლოებით 94 პროცენტით [27]. ჰიგიენის გაუმჯობესება სახლში მშობიარობის დროს რესურსებით შეზღუდული გარემოში ასევე მნიშვნელოვან როლს თამაშობს ახალშობილთა ტეტანუსის პრევენციაში.
პროგნოზი
არანეონატალური ტეტანუსის შემთხვევების სიკვდილიანობის მაჩვენებელი რესურსებით შეზღუდულ ქვეყნებში მერყეობს 5-დან 50 პროცენტამდე [27,63], მაშინ როცა ტეტანუსის მქონე პაციენტების უმრავლესობა გამოჯანმრთელდება, როდესაც ხელმისაწვდომია თანამედროვე დამხმარე საშუალებები [64]. გრძელვადიანი ფუნქციური შედეგი ზრდასრულთა გადარჩენილების შემთხვევაში შეიძლება შემცირდეს, განსაკუთრებით ხანდაზმულებში [63,65,66]. იაპონიაში ტეტანუსის გადარჩენილი 465 ადამიანიდან 290 გაწერეს სახლში, დანარჩენი კი სხვა დაწესებულებებში [66]. საფრანგეთში, ტეტანუსის გამო ინტენსიური თერაპიის განყოფილებაში გადარჩენილი 70 პაციენტიდან მხოლოდ 61,5 პროცენტს არ ჰქონდა ფუნქციური ინვალიდობა [65].
ახალშობილთა ტეტანუსი, რომელიც ოდესღაც თითქმის ყოველთვის ფატალური იყო, ახლა სიკვდილიანობა 3-დან 88 პროცენტამდეა [27]. პაციენტებს უფრო მოკლე ინკუბაციური პერიოდით (მაგ., ≤7 დღე) აღენიშნებათ დაავადების მძიმე მიმდინარეობა და სიკვდილიანობა [27,67]
ახალშობილთა ინფექციებს შორის გადარჩენილები შეიძლება სრულად გამოჯანმრთელდნენ ან ჰქონდეთ სხვადასხვა ხარისხის ნევროლოგიური დაზიანება, დაწყებული მცირე ინტელექტუალური დეფიციტიდან ცერებრალური დამბლით დამთავრებული [68].
შეჯამება და რეკომენდაციები
●ეპიდემიოლოგია – მიუხედავად იმისა, რომ ტეტანუსი ამჟამად იშვიათია, დაავადება კვლავ რჩება საფრთხედ ყველა არავაქცინირებული ადამიანისთვის, განსაკუთრებით შეზღუდული რესურსების მქონე ქვეყნებისთვის. ვინაიდან C. tetani სპორების აღმოიფხვრა გარემოდან შეუძლებელია, იმუნიზაცია, ჭრილობებისა და ტრავმული დაზიანებები სათანადო მკურნალობა გადამწყვეტ ფაქტორად რჩება ტეტანუსის პროფილაქტიკისთვის.
●კლინიკური მახასიათებლები/დიაგნოზი – ტეტანუსის ყველაზე გავრცელებული და მძიმე კლინიკური ფორმა არის გენერალიზებული ტეტანუსი. ასეთი პაციენტთა 80 პროცენტზე მეტის გამომჟღავნებელი სიმპტომია ტრიზმი, თუმცა გენერალიზებული ტეტანუსის მქონე პაციენტებს ზოგჯერ თავდაპირველად აღენიშნებათ ცეფალური ან ლოკალიზებული ტეტანუსი. ზოგადი ტეტანუსის მქონე პაციენტებს ჩვეულებრივ აღენიშნებათ ავტონომიური ჭარბი აქტივობის სიმპტომები, რომლებიც შეიძლება გამოვლინდეს ადრეულ ფაზებში, როგორც ოფლიანობა და ტაქიკარდია. ავადმყოფობის შემდგომ ფაზებში ხშირად გვხვდება უხვი ოფლიანობა, გულის რითმის დარღვევები, ლაბილური ჰიპერტენზია ან ჰიპოტენზია და ცხელება.
მენეჯმენტი
• დამხმარე ზრუნვა – დამხმარე ზრუნვა არის მენეჯმენტის საფუძველი, რათა თავიდან იქნას აცილებული ისეთი გართულებები, როგორიცაა სუნთქვის უკმარისობა, ნოზოკომიური ინფექციები და თრომბოემბოლია. (იხილეთ „საჰაერო გზების მართვა და სხვა დამხმარე ზომები“ ზემოთ).
•ტოქსინების წარმოების შეჩერება და განეიტრალება – ვინაიდან ტეტანუსი ტოქსინითაა გამოწვეული, თერაპიის გადამწყვეტი ასპექტია ტოქსინების მიმდინარე წარმოების აღმოფხვრა. ეს მოიცავს ჭრილობის დამუშაბებას და ანტიმიკრობული თერაპიის ჩატარებას (მაგ. მეტრონიდაზოლი 500 მგ ინტრავენურად ყოველ ექვს-რვა საათში 7-დან 10 დღის განმავლობაში). გარდა ამისა, პაციენტებმა უნდა მიიღონ პასიური იმუნიზაცია ანტიტოქსინით (მაგ. ადამიანის ტეტანუსის იმუნოგლობულინით) შეუკავშირებელი ტოქსინის გასანეიტრალებლად. (იხილეთ „ტოქსინის წარმოების შეჩერება“ ზემოთ და „უკავშირებელი ტოქსინის ნეიტრალიზაცია“).
•კუნთების სპაზმების კონტროლი – კუნთების სპაზმი კონტროლდება სედაციით (ჩვეულებრივ ბენზოდიაზეპინები) ან ნეირომუსკულური ბლოკადით. (იხილეთ „კუნთების სპაზმის კონტროლი“ ზემოთ.)
•ავტონომიური დისფუნქცია – ავტონომიური ჰიპერაქტიურობის მკურნალობა შესაძლებელია ლაბეტალოლით ან მორფინის სულფატით.
მაგნიუმის სულფატის გამოყენებამ როგორც ავტონომიური დისფუნქციის, ასევე კუნთების სპაზმების დამატებითი კონტროლისთვის დიდი ინტერესი გამოიწვია. ეს პრეპარატი ხელმისაწვდომია და გამოიყენება მთელ მსოფლიოში ეკლამფსიის სამკურნალოდ. (იხილეთ „ვეგეტატიური დისფუნქციის მართვა“ ზემოთ).
•აქტიური იმუნიზაცია – ტეტანუსის მქონე ყველა პაციენტმა უნდა მიიღოს აქტიური იმუნიზაცია ტეტანუსის და დიფტერიის ტოქსოიდის შემცველი ვაქცინების სრული სერიით (მაგ. მოზრდილებში და ბავშვებში 7 წელზე უფროსი ასაკის სამი დოზით); ტეტანუსი არის იმ რამდენიმე ბაქტერიული დაავადებადან, რომელიც არ ტოვებს იმუნიტეტს მწვავე ავადმყოფობის გამოჯანმრთელების შემდეგ. იმუნიზაცია დაუყოვნებლივ უნდა დაიწყოს დიაგნოზის შემდეგ და ვაქცინები უნდა ჩატარდეს ტეტანუსის იმუნოგლობულინისგან განსხვავებულ ადგილას. (იხილეთ „აქტიური იმუნიზაცია“ ზემოთ.)
REFERENCES
- Centers for Disease Control and Prevention. Tetanus. https://www.cdc.gov/vaccines/pubs/surv-manual/chpt16-tetanus.html (Accessed on May 05, 2024).
- Roper L, Hall MAK, Cohn A. Overview of the United States’ Immunization Program. J Infect Dis 2021; 224:S443.
- Centers for Disease Control and Prevention (CDC). Tetanus surveillance — United States, 2001-2008. MMWR Morb Mortal Wkly Rep 2011; 60:365.
- Yen C, Murray E, Zipprich J, et al. Missed opportunities for tetanus postexposure prophylaxis–California, January 2008-March 2014. MMWR Morb Mortal Wkly Rep 2015; 64:243.
- Yaffee AQ, Day DL, Bastin G, et al. Notes from the Field: Obstetric Tetanus in an Unvaccinated Woman After a Home Birth Delivery – Kentucky, 2016. MMWR Morb Mortal Wkly Rep 2017; 66:307.
- Berger SA, Cherubin CE, Nelson S, Levine L. Tetanus despite preexisting antitetanus antibody. JAMA 1978; 240:769.
- Bampoe VD, Brown N, Deng L, et al. Serologic Immunity to Tetanus in the United States, National Health and Nutrition Examination Survey, 2015-2016. Clin Infect Dis 2024; 78:470.
- Gergen PJ, McQuillan GM, Kiely M, et al. A population-based serologic survey of immunity to tetanus in the United States. N Engl J Med 1995; 332:761.
- Tetanus in England: 2021. Available at: https://www.gov.uk/government/publications/tetanus-in-england-annual-reports/tetanus-in-england-2021 (Accessed on May 07, 2024).
- Collins S, Amirthalingam G, Beeching NJ, et al. Current epidemiology of tetanus in England, 2001-2014. Epidemiol Infect 2016; 144:3343.
- Tetanus – Annual Epidemiological Report for 2021. European Centre for Disease Prevention and Control. Available at: https://www.ecdc.europa.eu/en/publications-data/tetanus-annual-epidemiological-report-2021 (Accessed on January 30, 2025).
- Chen W, Chen Y, Cheng Z, et al. Global patterns of syphilis, gonococcal infection, typhoid fever, paratyphoid fever, diphtheria, pertussis, tetanus, and leprosy from 1990 to 2021: findings from the Global Burden of Disease Study 2021. Infect Dis Poverty 2024; 13:66.
- World Health Organization. Tetanus. https://www.who.int/news-room/fact-sheets/detail/tetanus (Accessed on January 30, 2025).
- Afshar M, Raju M, Ansell D, Bleck TP. Narrative review: tetanus-a health threat after natural disasters in developing countries. Ann Intern Med 2011; 154:329.
- Nanteza B, Galukande M, Aceng J, et al. The burden of tetanus in Uganda. Springerplus 2016; 5:705.
- Kyu HH, Mumford JE, Stanaway JD, et al. Mortality from tetanus between 1990 and 2015: findings from the global burden of disease study 2015. BMC Public Health 2017; 17:179.
- Woldeamanuel YW, Andemeskel AT, Kyei K, et al. Case fatality of adult tetanus in Africa: Systematic review and meta-analysis. J Neurol Sci 2016; 368:292.
- World Health Organization. Immunization surveillance, assessment and monitoring. Maternal and Neonatal Tetanus (MNT) elimination. http://www.who.int/immunization_monitoring/diseases/MNTE_initiative/en/index.html (Accessed on May 05, 2024).
- Jones CE, Yusuf N, Ahmed B, et al. Progress Toward Achieving and Sustaining Maternal and Neonatal Tetanus Elimination – Worldwide, 2000-2022. MMWR Morb Mortal Wkly Rep 2024; 73:614.
- Lalli G, Bohnert S, Deinhardt K, et al. The journey of tetanus and botulinum neurotoxins in neurons. Trends Microbiol 2003; 11:431.
- Deinhardt K, Berninghausen O, Willison HJ, et al. Tetanus toxin is internalized by a sequential clathrin-dependent mechanism initiated within lipid microdomains and independent of epsin1. J Cell Biol 2006; 174:459.
- Schiavo G, Benfenati F, Poulain B, et al. Tetanus and botulinum-B neurotoxins block neurotransmitter release by proteolytic cleavage of synaptobrevin. Nature 1992; 359:832.
- Caccin P, Rossetto O, Rigoni M, et al. VAMP/synaptobrevin cleavage by tetanus and botulinum neurotoxins is strongly enhanced by acidic liposomes. FEBS Lett 2003; 542:132.
- Fabris F, Megighian A, Rossetto O, et al. Local Tetanus Begins with a Neuromuscular Junction Paralysis around the Site of Tetanus Neurotoxin Release due to Cleavage of the Vesicle-Associated Membrane Protein. Am J Pathol 2024; 194:1752.
- Farrar JJ, Yen LM, Cook T, et al. Tetanus. J Neurol Neurosurg Psychiatry 2000; 69:292.
- Rummel A, Bade S, Alves J, et al. Two carbohydrate binding sites in the H(CC)-domain of tetanus neurotoxin are required for toxicity. J Mol Biol 2003; 326:835.
- Thwaites CL, Beeching NJ, Newton CR. Maternal and neonatal tetanus. Lancet 2015; 385:362.
- Grund JM, Toledo C, Davis SM, et al. Notes from the Field: Tetanus Cases After Voluntary Medical Male Circumcision for HIV Prevention–Eastern and Southern Africa, 2012-2015. MMWR Morb Mortal Wkly Rep 2016; 65:36.
- Gonzales y Tucker RD, Frazee B. View from the front lines: an emergency medicine perspective on clostridial infections in injection drug users. Anaerobe 2014; 30:108.
- Ergonul O, Egeli D, Kahyaoglu B, et al. An unexpected tetanus case. Lancet Infect Dis 2016; 16:746.
- Centers for Disease Control and Prevention. Epidemiology and Prevention of Vaccine-Preventable Diseases. Tetanus. https://www.cdc.gov/vaccines/pubs/pinkbook/tetanus.html (Accessed on September 06, 2017).
- Doshi A, Warrell C, Dahdaleh D, Kullmann D. Just a graze? Cephalic tetanus presenting as a stroke mimic. Pract Neurol 2014; 14:39.
- Weinstein L. Tetanus. N Engl J Med 1973; 289:1293.
- Idema CD, Harris BN, Ogunbanjo GA, Dürrheim DN. Neonatal tetanus elimination in Mpumalanga Province, South Africa. Trop Med Int Health 2002; 7:622.
- Roper MH, Vandelaer JH, Gasse FL. Maternal and neonatal tetanus. Lancet 2007; 370:1947.
- Thwaites CL, Yen LM, Glover C, et al. Predicting the clinical outcome of tetanus: the tetanus severity score. Trop Med Int Health 2006; 11:279.
- Andreadou E, Kattoulas E, Sfagos C, Vassilopoulos D. Stiff person syndrome: avoiding misdiagnosis. Neurol Sci 2007; 28:35.
- Rodrigo C, Fernando D, Rajapakse S. Pharmacological management of tetanus: an evidence-based review. Crit Care 2014; 18:217.
- Campbell JI, Lam TM, Huynh TL, et al. Microbiologic characterization and antimicrobial susceptibility of Clostridium tetani isolated from wounds of patients with clinically diagnosed tetanus. Am J Trop Med Hyg 2009; 80:827.
- Ahmadsyah I, Salim A. Treatment of tetanus: an open study to compare the efficacy of procaine penicillin and metronidazole. Br Med J (Clin Res Ed) 1985; 291:648.
- Yen LM, Dao LM, Day NPJ. Management of tetanus: a comparison of penicillin and metronidazole. Symposium of antimicrobial resistance in southern Viet Nam, 1997.
- Saltoglu N, Tasova Y, Midikli D, et al. Prognostic factors affecting deaths from adult tetanus. Clin Microbiol Infect 2004; 10:229.
- Ganesh Kumar AV, Kothari VM, Krishnan A, Karnad DR. Benzathine penicillin, metronidazole and benzyl penicillin in the treatment of tetanus: a randomized, controlled trial. Ann Trop Med Parasitol 2004; 98:59.
- Johnson EA, Summanen P, Finegold SM. Clostridium. In: Manual of Clinical Microbiology, 9th edition, Murray PR, Baron EJ, Jorgensen JH, et al (Eds), ASM Press, Washington DC 2007. Vol 1, p.889.
- Vakil BJ, Tulpule TH, Armitage P, Laurence DR. A comparison of the value of 200,000 I.U. of tetanus antitoxin (horse) with 10,000 I.U. in the treatment of tetanus. Clin Pharmacol Ther 1968; 9:465.
- American Academy of Pediatrics. Tetanus (lockjaw). In: Red Book: 2009 Report of the Committee on Infectious Diseases, 28th, American Academy of Pediatrics, Elk Grove Village, IL 2009. p.655.
- Centers for Disease Control and Prevention. Tetanus – Wound Management. https://www.cdc.gov/vaccines/pubs/pinkbook/tetanus.html#medical (Accessed on February 24, 2020).
- Van Hao N, Loan HT, Yen LM, et al. Human versus equine intramuscular antitoxin, with or without human intrathecal antitoxin, for the treatment of adults with tetanus: a 2 × 2 factorial randomised controlled trial. Lancet Glob Health 2022; 10:e862.
- Miranda-Filho Dde B, Ximenes RA, Barone AA, et al. Randomised controlled trial of tetanus treatment with antitetanus immunoglobulin by the intrathecal or intramuscular route. BMJ 2004; 328:615.
- Constrained U.S. Td supply, 2024. Centers for Disease Control and Prevention. Available at: https://www.cdc.gov/vaccines/vpd/dtap-tdap-td/hcp/recommendations.html#constrained-supply-2024 (Accessed on May 07, 2024).
- Engrand N, Guerot E, Rouamba A, Vilain G. The efficacy of intrathecal baclofen in severe tetanus. Anesthesiology 1999; 90:1773.
- Santos ML, Mota-Miranda A, Alves-Pereira A, et al. Intrathecal baclofen for the treatment of tetanus. Clin Infect Dis 2004; 38:321.
- Engrand N, Vilain G, Rouamba A, Benhamou D. [Value of intrathecal baclofen in the treatment of severe tetanus in the tropical milieu]. Med Trop (Mars) 2000; 60:385.
- Thwaites CL, Yen LM, Loan HT, et al. Magnesium sulphate for treatment of severe tetanus: a randomised controlled trial. Lancet 2006; 368:1436.
- Lipman J, James MF, Erskine J, et al. Autonomic dysfunction in severe tetanus: magnesium sulfate as an adjunct to deep sedation. Crit Care Med 1987; 15:987.
- Attygalle D, Rodrigo N. Magnesium as first line therapy in the management of tetanus: a prospective study of 40 patients. Anaesthesia 2002; 57:811.
- James MF, Manson ED. The use of magnesium sulphate infusions in the management of very severe tetanus. Intensive Care Med 1985; 11:5.
- Ceneviva GD, Thomas NJ, Kees-Folts D. Magnesium sulfate for control of muscle rigidity and spasms and avoidance of mechanical ventilation in pediatric tetanus. Pediatr Crit Care Med 2003; 4:480.
- Lanuza PDT, Garcia JJB, Turalde CWR, Prado MJB. Clinical profile and outcomes of tetanus patients in a tertiary hospital in the Philippines: a ten-year retrospective study. BMC Infect Dis 2024; 24:142.
- Osalusi BS, Ogun SA, Ogunniyi A, Kolapo KO. Comparison of the efficacy of magnessium sulphate. Scientific Research and Essay 2008; 3:571.
- Ali G, Kamal M, Khan AN. Comparison of the efficacy of magnesium sulphate and diazepam in the control of tetanus spasm. J Pak Med Assoc 2011; 25:106.
- Buchanan N, Smit L, Cane RD, De Andrade M. Sympathetic overactivity in tetanus: fatality associated with propranolol. Br Med J 1978; 2:254.
- Trung TN, Duoc NVT, Nhat LTH, et al. Functional outcome and muscle wasting in adults with tetanus. Trans R Soc Trop Med Hyg 2019; 113:706.
- Trujillo MH, Castillo A, España J, et al. Impact of intensive care management on the prognosis of tetanus. Analysis of 641 cases. Chest 1987; 92:63.
- Mahieu R, Reydel T, Maamar A, et al. Admission of tetanus patients to the ICU: a retrospective multicentre study. Ann Intensive Care 2017; 7:112.
- Nakajima M, Aso S, Matsui H, et al. Clinical features and outcomes of tetanus: Analysis using a National Inpatient Database in Japan. J Crit Care 2018; 44:388.
- Patel JC, Mehta BC. Tetanus: study of 8,697 cases. Indian J Med Sci 1999; 53:393.
- Barlow JL, Mung’Ala-Odera V, Gona J, Newton CR. Brain damage after neonatal tetanus in a rural Kenyan hospital. Trop Med Int Health 2001; 6:305.

